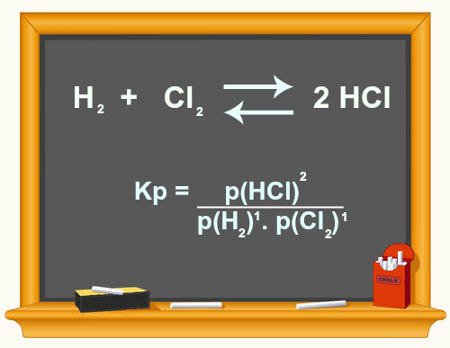
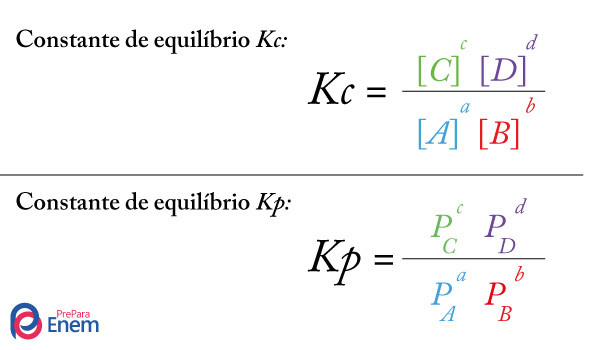O cálculo do Kc de uma reação é uma ferramenta essencialmente experimental utilizada para verificar qual é a tendência que um determinado equilíbrio químico apresenta com relação a reagentes e produtos. Veja uma equação que representa um equilíbrio químico:
Por intermédio do cálculo do Kc, é possível prever se após o equilíbrio ser atingido, ele continua acontecendo e se tende para o lado dos reagentes, para o lado dos produtos ou se as concentrações molares de ambos (reagentes e produtos) é a mesma.
Para o cálculo do Kc de uma reação, precisamos dos seguintes itens:
-
A equação química que representa a reação química;
-
Os coeficientes que tornam a equação química balanceada;
-
A expressão do Kc da reação;
-
Os valores das concentrações molares (em mol/L) no equilíbrio de cada um dos componentes da reação que participam do Kc.
Expressão para o cálculo do Kc de uma reação
Para construir a expressão para o cálculo do Kc de uma reação, basta dividir o produto das concentrações dos produtos (elevados aos seus respectivos expoentes, ou seja, os coeficientes deles na equação química) pelo produto das concentrações dos reagentes, como no exemplo a seguir:
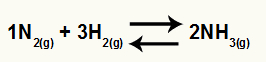
Equação química de formação da amônia a partir de N2 e H2
O Kc desse equilíbrio terá a concentração do NH3 (elevada a 2) no denominador, e o numerador terá a concentração do N2 (elevada a 1) multiplicada pela concentração do H2 (elevada a 3).
Kc = [NH3]2
[N2]1.[H2]3
OBS.: Vale ressaltar que os participantes no estado sólido e os líquidos puros não participam do Kc de uma reação.
Tabela para o cálculo do Kc
Considere como exemplo o equilíbrio químico de formação do gás amônia:
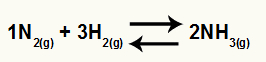
A montagem da tabela depende inicialmente de:
-
Valores das concentrações em mol/L de cada um dos reagentes;
-
Valor da concentração em mol/L no equilíbrio de pelo menos um dos produtos;
-
Equação da reação em equilíbrio balanceada;
-
Conhecer a estequiometria da reação (por meio do seu balanceamento).
A tabela para o cálculo do Kc sempre é composta de três diferentes momentos da reação: o início, o durante (quando está ocorrendo a formação dos produtos) e o equilíbrio.

Os dados que preenchem a tabela dependem do momento em que a reação está:
-
Início: teremos sempre os valores fornecidos pelo exercício para os reagentes e 0 mol/L para os produtos, já que no início imediato da reação não existem produtos;
-
Durante: Será formado pela quantidade de reagente gasto e pela quantidade de produto formado;
-
Equilíbrio: nos reagentes, é formado pela subtração dos valores do participante no início pelo durante; nos produtos, é formado pela soma entre os valores do participante no início e durante.
Suponha que uma reação foi realizada a partir de 5 mol/L de H2 e 5 mol/L de N2. No equilíbrio, foram encontrados 2 mol/L de NH3. Com esses dados, o caráter inicial da tabela será:
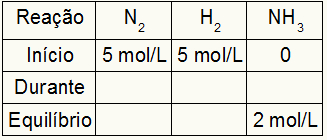
Como o equilíbrio do produto é a soma do início com o durante e o exemplo informa que no equilíbrio temos 2 mol/L de NH3, logo, o “durante” também será 2 mol/L.
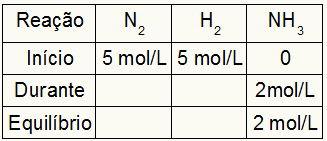
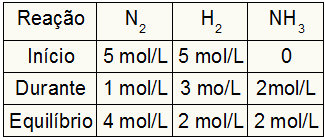
A estequiometria da reação é 1N2: 3H2: 2NH3, ou seja, tudo que ocorre (aumento ou diminuição de concentração) com o NH3, no N2, ocorre a metade. No H2, é 1,5 vezes maior. Assim, no “durante”, a concentração gasta de N2 é de 1,0 mol/L (por ser metade do NH3), já a concentração do H2 é de 3 mol/L.

Para finalizar a tabela e encontrar as concentrações de N2 e H2 no equilíbrio, basta subtrair os valores do início com os valores do “durante”. Com isso, o N2 terá no equilíbrio 4 mol/L, e o O2 terá 2 mol/L.
Exemplos de cálculos do Kc de uma reação
Exemplo I: (UNIRIO) Um dos graves problemas ambientais que enfrenta a sociedade é, sem dúvida, a poluição causada por poluentes oriundos da queima de combustíveis fósseis, originando assim precipitação de chuvas ácidas. Um dos equilíbrios envolvidos na formação desse tipo de poluição pode ser representado pela equação:
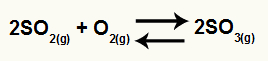
Considerando, hipoteticamente, uma situação atmosférica onde estão presentes em equilíbrio: 3 mols/L de SO2, 4 mols/L de O2 e 4 mols/L de SO3, o valor da constante de equilíbrio seria:
a) 9/4
b) 2/3
c) 1/2
d) 4/9
e) 1,0
Resolução: Como o exercício já forneceu os valores das concentrações em mol/L de todos os participantes, precisamos apenas fazer o seguinte:
-
1o Passo: Montar a expressão do Kc da reação;
O Kc desse equilíbrio terá a concentração do SO3 (elevada a 2) no denominador, e no numerador terá a concentração do SO2 (elevada a 2) multiplicada pela concentração do O2 (elevada a 1).
Kc = [SO3]2
[SO2]2.[O2]1
-
2o Passo: Utilizar os valores encontrados na expressão do Kc;
Para finalizar a questão, basta utilizar os valores das concentrações dos participantes na expressão determinada no primeiro passo:
Kc = [SO3]2
[SO2]2.[O2]1
Kc = (4)2
(3)2.(4)1
Kc = 16
9.4
Kc = 16
36
Kc = 4/9 ou 0,44 mol/L-1 (aproximadamente)
OBS.: A unidade está elevada a -1 porque temos numerador elevado ao quadrado (ou seja, mol/L ao quadrado) e, no denominador, temos SO2 elevado ao quadrado e O2 elevado a um. Resumindo: dois mol/L no numerador e três no denominador, logo, sobra um no denominador.
Exemplo 2: (ESCS-DF) Uma das etapas do processo industrial utilizado para a fabricação do ácido sulfúrico é a conversão de SO2 em SO3 segundo a reação:
.jpg)
Em um conversor de 100 L, foram colocados inicialmente 80 mols de cada um dos reagentes. Ao atingir o equilíbrio, foi constatada a presença de 60 mols de SO3. O valor da constante de equilíbrio (Kc) é igual a:
a) 52
b) 6
c) 0,055
d) 36
e) 18
Resolução: Como o exercício forneceu os valores dos reagentes utilizados no início da reação e o valor do produto no equilíbrio, devemos montar uma tabela para calcular as concentrações em mol/L de cada um dos reagentes no equilíbrio e o Kc. Acompanhe o passo a passo:
-
1o Passo: Cálculo da concentração em mol/L dos valores fornecidos pelo exercício, pois eles estão em mol e o volume é 100 L. Para isso, basta dividir a quantidade em mol pelo volume de 100 L.
[SO2] = 80 = 0,8 mol/L
100
[SO2] = 80 = 0,8 mol/L
100
[O2] = 80 = 0,8 mol/L
100
[SO3] = 60 = 0,6 mol/L
100
2o Passo: Montar a tabela para determinar as concentrações dos reagentes no equilíbrio
No início, temos 0,8 de cada reagente (SO2 e O2) e 0 mol/L do produto (início da reação). O exercício informa o valor da concentração do SO3 no equilíbrio: 0,6 mol/L.

Como o equilíbrio do produto é a soma do início com o “durante” e o exercício informa que no equilíbrio temos 0,6 mol/L de SO3, logo, o “durante” também será 0,6 mol/L.

A estequiometria da reação é 2SO2: 1O2: 2SO3, ou seja, tudo que ocorre (aumento ou diminuição de concentração) com o SO2 ou com o SO3, no O2, ocorre a metade. Assim, no “durante”, a concentração gasta de SO2 foi de 0,6 mol/L (por ele ser proporcional ao SO3). Já a concentração do O2 no “durante” é de 0,3 mol/L.

Para finalizar a tabela e encontrar as concentrações de SO2 e O2 no equilíbrio, basta subtrair seus valores do início com os valores do durante. Com isso, o SO2 terá no equilíbrio 0,2 mol/L, e o O2 terá 0,5 mol/L.

-
3o Passo: Utilizar os valores encontrados na expressão do Kc.
Como a equação desse exemplo é a mesma do anterior, ou seja, a expressão do Kc também é a mesma, para finalizar a questão, basta utilizar os valores das concentrações dos participantes:
Kc = [SO3]2
[SO2]2.[O2]1
Kc = (0,6)2
(0,2)2.(0,5)
Kc = 0,36
0,04.0,5
Kc = 0,36
0,02
Kc = 18 mol/L-1
Videoaula relacionada: