Uma solução é preparada quando se dissolve o soluto em um solvente e forma-se uma mistura homogênea, ou seja, com uma única fase até mesmo se for visualizada em um ultramicroscópio. Dois exemplos são uma mistura de água e sal de cozinha – cloreto de sódio (NaCl) – e uma mistura de água e açúcar (sacarose – (C12H22O11)).
Mas a quantidade de sal que conseguimos dissolver em determinada quantidade de água não será a mesma quantidade que conseguimos para o açúcar. Essa quantidade máxima de soluto que pode ser dissolvida em determinada quantidade de solvente, a uma dada temperatura, é chamada de coeficiente de solubilidade.
Veja a seguir alguns valores de coeficientes de solubilidade:
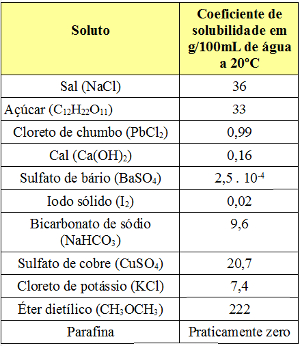
Valores de coeficientes de solubilidade de diferentes substâncias em 100 g de água a 20ºC
Isso mostra que o coeficiente de solubilidade depende da natureza do soluto e do solvente. A única forma de determinar o coeficiente de solubilidade de uma substância é experimentalmente, ou seja, é necessário realizar medições para cada tipo de soluto.
O coeficiente de solubilidade ajuda a determinar a saturação das soluções:
-
Insaturada: A quantidade de soluto dissolvida no solvente é inferior ao coeficiente de solubilidade;
-
Saturada: A quantidade de soluto dissolvida no solvente é igual ao coeficiente de solubilidade;
-
Supersaturada: A quantidade de soluto dissolvida no solvente é superior ao coeficiente de solubilidade;
Além da natureza do soluto e do solvente, a temperatura é outro fator que interfere no coeficiente de solubilidade. Por exemplo, o coeficiente de solubilidade do NH4Cl é de 37,2 g em 100 g de água a 20ºC. Isso significa que, se adicionarmos 10 g desse sal em 100 g de água a 20ºC, teremos uma solução insaturada e poderemos dissolver ainda mais sal.
Agora se colocarmos mais de 37,2 g de sal nessas condições, o excesso de sal não se dissolverá e ficará depositado no fundo do recipiente, sendo chamado de corpo de fundo, corpo de chão ou precipitado. Teremos, nesse caso, uma solução saturada com corpo de fundo. Se quisermos somente a solução saturada, basta filtrá-la, separando o precipitado.
No entanto, se colocarmos, por exemplo, 50 g de NH4Cl em 100 g de água e começarmos a aquecer o sistema, veremos que o sal que não tinha se dissolvido em 20ºC começará a dissolver-se. Isso acontece porque o coeficiente de solubilidade do NH4Cl em água aumenta com o aumento da temperatura, conforme o gráfico a seguir indica.
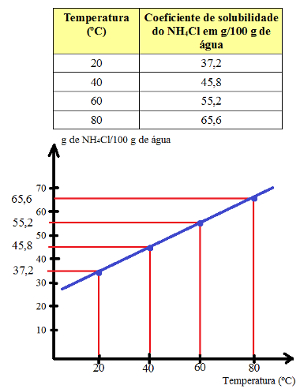
Coeficiente de solubilidade do NH4Cl em relação à temperatura
Dessa forma, o valor do coeficiente de solubilidade depende da temperatura. Em 40ºC, o coeficiente de solubilidade do NH4Cl é igual a 45,8 g em 100 g de água. Já, em 80ºC, esse coeficiente é de 65,6 g em 100 g de água.
Agora pense no seguinte: digamos que uma solução preparada com 50 g de NH4Cl em 100 g de água foi aquecida até a temperatura de 60ºC, e todo o sal foi dissolvido. A solução foi então deixada em repouso até voltar para a temperatura de 20ºC. Como não mexemos nessa solução, ela ficou com os 50 g do sal dissolvido, quando, na verdade, deveriam ser somente 37,2 g nessa temperatura. Portanto, temos uma solução supersaturada.
Porém, esse tipo de solução é muito instável e qualquer perturbação pode fazer o excesso de sal dissolvido (12,8 g) precipitar, formando uma solução saturada com corpo de fundo.
A maioria dos solutos que se dissolvem em água possui a variação do coeficiente de solubilidade igual ao do NH4Cl, isto é, aumenta com o aumento da temperatura. Mas existem alguns, como o hidróxido de cálcio (Ca(OH)2), em que o coeficiente de solubilidade diminui com o aumento da temperatura.
Existem também casos em que o aumento da temperatura praticamente não altera a solubilidade da substância. Por exemplo, o coeficiente de solubilidade do sal de cozinha é igual a 36 g em 100 g de água a 20ºC, mas, em 100ºC, esse valor sobe somente para 39,8 g/100 g de água.
Aproveite para conferir nossas videoaulas sobre o assunto: