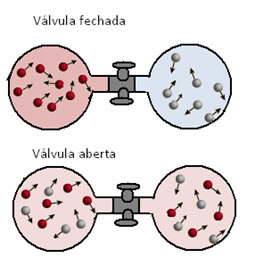
Difusão: é a propriedade que todos os gases têm de se misturar espontaneamente com outros gases resultando em misturas ou soluções homogêneas.
Isso pode ser visualizado no exemplo abaixo, em que foram colocados dois balões de vidro contendo gases diferentes. Ao abrir a válvula que separa esses gases, pode-se visualizar que as moléculas dos dois gases, por apresentarem um movimento contínuo e muito rápido, acabam se misturando com grande velocidade, originando uma mistura homogênea.
É por isso que conseguimos sentir o cheiro dos perfumes: algumas de suas moléculas se difundem ou se espalham pelo ar. Além disso, os gases que saem das chaminés das fábricas, do escapamento dos automóveis, a fumaça de queimadas ou de cigarros, difundem-se pelo ar e acabam “sumindo”, pois a proporção de volume do ar é muito maior.
Existe, porém, um tipo especial de difusão, que é a efusão.
Efusão: é a propriedade que os gases têm de passar através de pequenos orifícios.
Por exemplo, um balão preenchido de gás hélio com o passar do tempo acaba murchando. Isso ocorre porque o balão é constituído de paredes com pequenos orifícios ou poros, pelos quais o gás passa.

O cientista que estudou a efusão e a difusão dos gases foi o químico escocês Thomas Graham (1805-1869). Ele estabeleceu uma relação matemática entre as velocidades de difusão dos gases e suas massas molares nas mesmas condições de pressão e temperatura e criou uma lei:
Lei de Graham: em condições idênticas, as velocidades de difusão e efusão dos gases são inversamente proporcionais às raízes quadradas de suas densidades absolutas.
Matematicamente, temos a velocidade em relação às densidades dos gases:
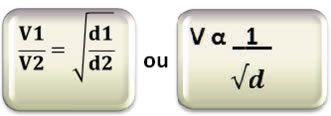
Relacionando com as massas molares, temos:
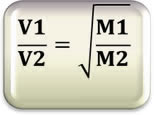
Isso nos mostra que quanto maior a densidade de um gás, maior a sua massa molar e menor a velocidade de difusão. Para exemplificar, imagine que dois frascos sejam abertos simultaneamente, um contém vinagre (contém ácido acético (H4C2O2)) e o outro detergente amoniacal (libera amônia gasosa (NH3)). Sentiremos primeiro o cheiro da amônia, pois sua massa molar é menor que a do ácido acético.
O mesmo se aplica ao caso da efusão, em que um gás contendo gás hélio (He, cuja massa molar é 4 g/mol) irá murchar com mais rapidez do que um com gás carbônico (CO2, com massa molar igual a 44 g/mol).