Os elementos químicos são constituídos por átomos. Isótopos são átomos com o mesmo número atômico e diferente número de massa, eles contribuem para a formação dos elementos radioativos: os radioisótopos.
Os isótopos podem se classificar em radioativos e não-radioativos, veja os exemplos:
Urânio:
238U92 235U92
Os isótopos do elemento Urânio possuem o mesmo número atômico, mas diferentes massas. O Urânio 235 é radioativo e é usado para construir os reatores nucleares e as bombas atômicas.
Hidrogênio:
1H1 2H1 3H1
O Hidrogênio com massa 1 é o mais abundante na natureza, este não é radioativo. O Hidrogênio com número de massa 2 é radioativo e dá origem às bombas de hidrogênio, já o Hidrogênio com massa 3, ocorre em quantidades menores e é também radioativo.
Cobalto:
59Co27 60Co27
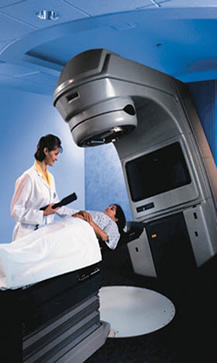
O Cobalto com número de massa 59 é o isótopo natural, já o Cobalto 60 é fabricado de modo artificial pelo bombardeamento do isótopo 59 com nêutrons, é aplicado no tratamento de tumores.
Carbono:
12C6 14C6
O Carbono 12 é o mais comum, o Carbono 14 é um radioisótopo artificial, embora também exista na atmosfera. É denominado de contador radioativo do tempo, através da contagem da meia-vida do carbono (5.600 anos). Esse processo é útil para revelar a idade de plantas, múmias e fósseis.
Os isótopos estão sendo cada vez mais utilizados, e de formas variadas: na agricultura, na engenharia, na medicina, etc.