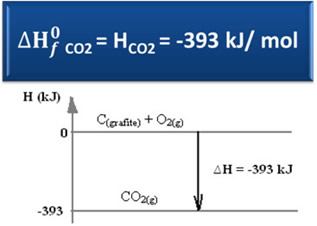
Considere a seguinte reação de formação do gás carbônico a partir do grafite e do oxigênio:
C(grafite) + O2(g) → CO2(g) ∆H = -393 kJ (25ºC, 1 atm)
Conforme dito no texto “Entalpia-Padrão”, a entalpia de substâncias simples, no estado padrão e na sua forma alotrópica mais estável, é igual a zero. Portanto, observe que na reação acima as duas substâncias reagentes (C(grafite) e O2(g)) estão no estado padrão, pois são as formas alotrópicas mais estáveis do carbono e do oxigênio, respectivamente. Consequentemente, suas entalpias-padrão são iguais a zero.
Usando, então, a fórmula de cálculo da variação da entalpia, podemos definir qual é a entalpia para o dióxido de carbono:
∆H = Hprodutos – Hreagentes
∆H = (HCO2) – (HC(grafite) + HO2)
-393 kJ = (HCO2) – (0 + 0)
HCO2 = -393 kJ
Veja que a entalpia, ou o conteúdo energético do gás carbônico, deu negativa, no sentido de que ela é menor que as entalpias dos reagentes, as quais, por convenção, são iguais a zero.
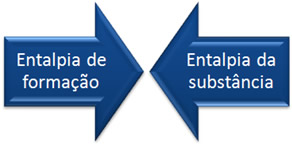
Esse exemplo constitui a reação de formação do CO2. Assim, a partir do que foi visto, podemos chegar à seguinte definição para entalpia-padrão de formação:

Outras denominações dadas para essa grandeza são: entalpia de formação, calor de formação ou ∆H de formação. Sua representação é dada por ∆Hf0 e é medida em quilojoules por mol (kJ/mol).
Assim, para o caso citado temos:
Vimos que o valor da entalpia de formação é igual à entalpia da substância produzida.
Se estivéssemos considerando outra reação de formação do gás carbônico, como a mostrada a seguir, ela não poderia ser usada para indicar a entalpia de formação do CO2, assim como fizemos nesse caso, porque ela não é realizada com todos os reagentes no estado-padrão:
C(diamante) + O2(g) → CO2(g) ∆H = -395,9 kJ/mol
Observe que o diamante não é a forma alotrópica mais estável do carbono, portanto sua entalpia-padrão não é igual a zero. Veja também que o valor da entalpia de formação dessa reação em relação à anterior é diferente.
Outro exemplo ocorre na reação de formação da água:
1 H2(g) + ½ O2(g) → 1 H2O(l) ∆H = -68,3 kcal
Baseado no que vimos, podemos concluir que a entalpia de formação da água é igual a -68,3 kcal ou -286,0313 kJ/mol.
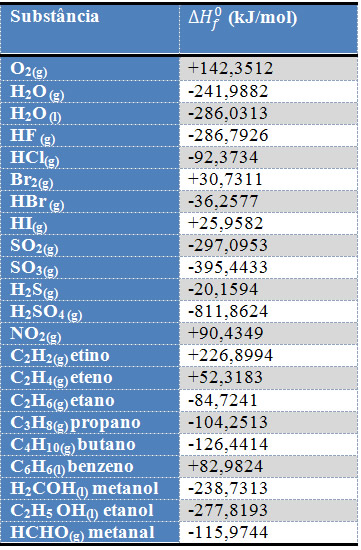
Por meio desse método é possível determinar a entalpia de formação de vários compostos a partir de seus elementos constituintes, que são substâncias simples. A seguir temos uma tabela com valores de entalpias de formação para várias substâncias: