Conforme dito no texto “Entalpia”, não é possível calcular a entalpia (H) que cada substância apresenta. Assim, costuma-se calcular não a entalpia, mas a variação de entalpia (∆H) do processo. Isso é feito através da diferença entre a entalpia dos produtos (entalpia final) e a entalpia dos reagentes (entalpia inicial).
Porém, mesmo a variação da entalpia também depende de vários fatores, sendo que um deles é a quantidade de matéria envolvida. Por exemplo, considere a reação entre o grafite e o oxigênio para a formação do dióxido de carbono com três quantidades de matéria diferentes:
a) C(grafite) + O2(g) → CO2(g) ∆H = -393 kJ (25ºC, 1 atm)
b) ½ C(grafite) + ½ O2(g) → ½ CO2(g) ∆H = -196,5 kJ (25ºC, 1 atm)
c) 2 C(grafite) + 2 O2(g) → 2 CO2(g) ∆H = -786 kJ (25ºC, 1 atm)
Observe que a quantidade de calor eliminado nessas reações é diretamente proporcional às quantidades de matéria de seus participantes. Pois, ao se diminuir pela metade o número de mols na equação b, a variação da entalpia também reduziu pela metade; e quando se dobrou, no caso da equação c, o ∆H também dobrou de valor.
Existem ainda outros fatores que alteram os valores da entalpia; dentre eles, a temperatura, a pressão, o estado físico e a variedade alotrópica. Isso nos mostra que houve a necessidade de se criar um referencial para se fazer comparações entre as entalpias. A fim de facilitar a determinação das entalpias de diferentes reações, criou-se a entalpia-padrão, sendo que esse termo pode ser enunciado da seguinte forma:

A temperatura e a pressão citadas acima são as utilizadas no caso de gases; quando se trata de soluções, a entalpia também é determinada na concentração de 1 mol/L.
Se todos os reagentes e todos os produtos de uma reação estiverem no seu estado padrão, então a variação da entalpia será indicada pelo símbolo ∆H0. Com isso, ficou convencionado o seguinte:

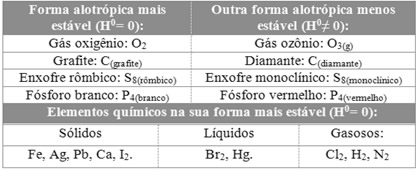
Veja alguns exemplos da entalpia-padrão de substâncias simples e de formas alotrópicas:
- A forma mais estável do hidrogênio é H2(g), a 25 ºC e 1 atm, encontrando-se no estado gasoso; assim, o H2(g), nessas condições, apresenta H0= 0. Em qualquer outra condição o hidrogênio terá entalpia H0≠ 0;
- A forma mais estável do ferro é Fe(s), a 25 ºC e 1 atm, encontrando-se no estado sólido; assim, o Fe(s), nessas condições, apresenta H0= 0. Em qualquer outra condição o ferro terá entalpia H0≠ 0;
- A forma mais estável do bromo é Br(l), a 25 ºC e 1 atm, encontrando-se no estado líquido; assim, o Br(l), nessas condições, apresenta H0= 0. Em qualquer outra condição o bromo terá entalpia H0≠ 0;
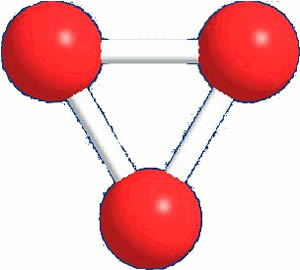
- O oxigênio possui dois alótropos: o gás oxigênio (O2(g)) e o ozônio (O3(g)). Desses dois, o mais comum é o O2, portanto, ele possui H0= 0; e o O3 apresenta H0≠ 0;
- Entre o diamante (C(diamante)) e o grafite (C(grafite)), que são variedades alotrópicas do carbono, o grafite é o mais estável e apresenta H0= 0;
- Entre o enxofre rômbico e o enxofre monoclínico, o rômbico é o mais estável, apresentando H0= 0.