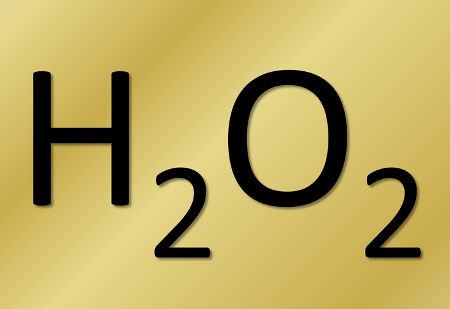No nosso dia a dia usamos vários símbolos para representar ideias, informações, conteúdos, obrigações, ordens e leis de forma mais simplificada; como, por exemplo, as notas musicais, os sinais das placas de trânsito, os símbolos matemáticos e assim por diante. Na Química isso também ocorre. As reações químicas, ou fenômenos químicos, em que há a mudança da constituição da matéria, são representados por Equações Químicas.
O esquema das equações químicas consiste em colocar os reagentes (substâncias iniciais) do lado esquerdo da seta e os produtos (substâncias formadas, finais) do lado direito da seta:

Por exemplo, considere a reação de formação da água (H2O), em que são necessárias duas moléculas de hidrogênio (cuja fórmula molecular que o simboliza é H2) e uma molécula de oxigênio (O2), conforme mostrado abaixo:
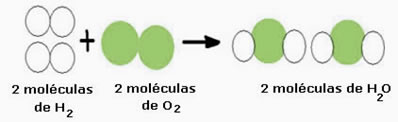
Essa reação pode ser representada por uma equação química da seguinte forma:
Reagentes → Produtos
Gás hidrogênio + gás oxigênio → água
Equação Química: 2 H2 + O2 → 2 H2O
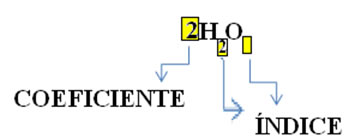
Observe que se coloca como símbolo de cada substância a sua fórmula molecular, em que o número subscrito do lado direito do número é denominado índice e indica a quantidade de átomos de cada elemento que está presente naquela molécula.
Além disso, indica-se também a proporção em que essas substâncias reagem por meio dos coeficientes estequiométricos, ou seja, dos números escritos antes das fórmulas. Observe que quando o índice ou o coeficiente é igual a 1, não é necessário escrevê-lo.
Assim, temos:
Além desses símbolos existem outros ainda que podem ser adicionados, tais como os mostrados a seguir:
- Indicar o estado físico: gasoso (g), vapor (v), líquido (l) e sólido (s). É possível ainda aparecer o símbolo (aq), indicando que há moléculas ou íons dissolvidos na água – ou seja, é uma solução aquosa.
Observe como esses símbolos aparecem em uma possível reação de formação da chuva ácida:
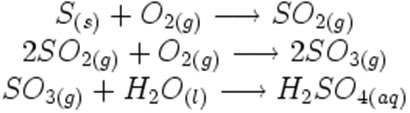
-
Desprendimento de gás: (
 )
)
Na reação de síntese ou adição abaixo vemos que duas substâncias reagem, originando o gás carbônico que se desprende:
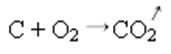
- Precipitação: (↓)
Exemplo:
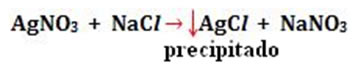
-
Aquecimento:
Exemplo: observe como esse símbolo aparece na reação de calcinação ou pirólise abaixo, que costuma ser feita em indústrias para decompor substâncias por meio do calor:
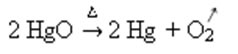
-
Presença de luz:
Exemplo: a reação a seguir é de fotólise, ou seja, ocorre a decomposição da água oxigenada pela luz:
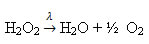
-
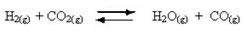
Ocorrência de reações reversíveis:
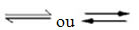
Por exemplo, considere a reação em equilíbrio entre gás hidrogênio e gás carbônico (dióxido de carbono):