O texto “Forças Intermoleculares ou Forças de Van der Waals” mostrou que existem três dessas forças, que são: dipolo induzido, dipolo permanente e ligação de hidrogênio.
A força de dipolo permanente pode ser chamada também de interação dipolo-dipolo ou dipolo permanente-dipolo permanente. Ela tem intensidade média, uma vez que a dipolo induzido é a mais fraca e a ligação de hidrogênio é a mais forte.
Esse tipo de interação é a que ocorre entre moléculas polares, na qual a distribuição da carga elétrica sobre a molécula não é uniforme e, portanto, os dipolos elétricos são permanentes.
Por exemplo, o HCl é uma molécula que exemplifica essa ocorrência, pois a densidade eletrônica se concentra mais sobre o átomo de cloro, por ele ser eletronegativo, assim ocorre atração dos elétrons para ele. Dessa forma, o hidrogênio representa o polo positivo da molécula e o cloro o polo negativo. Abaixo poderemos ver como as interações dipolo permanente ocorrem com essas substâncias, sendo que o polo positivo de uma molécula atrai o polo negativo da molécula vizinha e vice-versa.
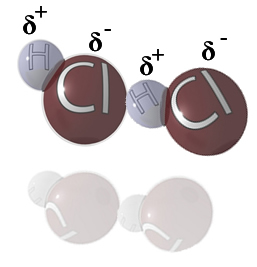
Isso também ocorre com as moléculas das seguintes substâncias: HBr, H2S, CO, HCCl3, SO2.
Visto que são de intensidade mais forte em relação à força de dipolo induzido, para romper as interações de dipolo permanente, separar as moléculas e fazer a substância mudar de estado físico, deve-se utilizar uma maior energia. Por isso, os pontos de ebulição e de fusão dessas substâncias são maiores.
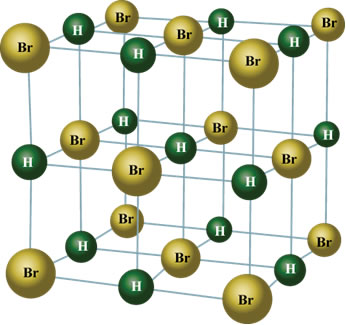
No estado sólido, o dipolo permanente orienta as posições das moléculas no espaço de modo a formar cristais, tais como o mostrado abaixo:
Aproveite para conferir nossas videoaulas relacionadas ao assunto: