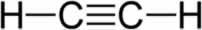Os hidrocarbonetos são os compostos orgânicos mais simples, pois possuem apenas carbono e hidrogênio em sua composição. Contudo, também são os mais importantes e utilizados no cotidiano, uma vez que são, em maioria, derivados do petróleo. Sendo assim, compõem os combustíveis (como gás natural, gasolina e diesel), resinas e também os plásticos em grande maioria.
Os hidrocarbonetos podem ser divididos conforme a sua cadeia carbônica: aberta (alcanos, alcenos, alcinos e alcadienos), fechada (cicloalcanos e cicloalcenos) ou aromática. Sua fórmula molecular geral é CxHy, na qual x e y representam números inteiros.
Leia também: Ácidos graxos — compostos presentes em óleos e gorduras vegetais e animais

Tópicos deste artigo
- 1 - Tipos de hidrocarbonetos
- 2 - Propriedades dos hidrocarbonetos
- 3 - Nomenclatura dos hidrocarbonetos
- 4 - Onde se encontram os hidrocarbonetos?
- 5 - Função dos hidrocarbonetos
- 6 - Exercícios resolvidos
Tipos de hidrocarbonetos
Como antes dito, os hidrocarbonetos são divididos conforme o tipo de sua cadeia carbônica.
Entre os hidrocarbonetos de cadeia aberta, encontram-se os:
-
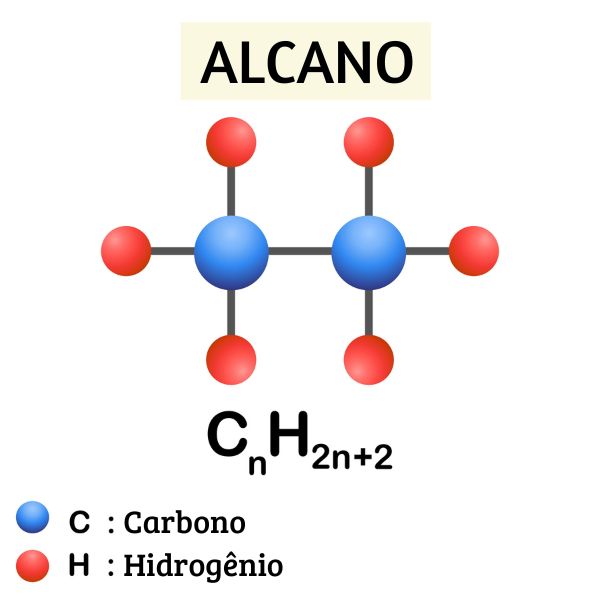
alcanos (ou parafinas): possuem apenas ligação simples entre os carbonos;
-
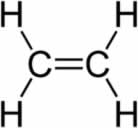
alcenos (ou alquenos, ou olefinas): possuem uma ligação dupla entre os carbonos;
-
alcinos (ou alquinos): possuem uma ligação tripla entre os carbonos;
-
alcadienos: possuem duas ligações duplas entre os carbonos.
Já entre os hidrocarbonetos de cadeia fechada, encontram-se os:
-
cicloalcanos (ou ciclanos): possuem apenas ligação simples entre os carbonos;
-
cicloalcenos (ou ciclenos): possuem uma ligação dupla entre os carbonos.
Há também os hidrocarbonetos de cadeia aromática, ou seja, hidrocarbonetos que possuem pelo menos um anel (ou núcleo) aromático.
Propriedades dos hidrocarbonetos
De todas as propriedades físico-químicas dos hidrocarbonetos, a mais importante é a de que eles são compostos apolares. Pelo fato de serem apolares, os hidrocarbonetos não são solúveis em água, um solvente polar. Deve-se lembrar que, segundo a regra do semelhante, compostos apolares somente são solúveis em outros compostos apolares, assim como compostos polares somente são solúveis em outros compostos polares.

Também por serem apolares, os hidrocarbonetos possuem baixo ponto de fusão e ebulição quando comparados a compostos polares de massa molecular semelhante, pois as forças de interação entre moléculas apolares, chamadas de Forças de van der Waals (ou Forças de London, ou interação dipolo induzido-dipolo induzido), são mais fracas que as forças de interação entre moléculas polares, chamadas de interação dipolo-dipolo.
Porém, entre os hidrocarbonetos, percebe-se que os pontos de fusão e ebulição aumentam conforme sua cadeia aumenta, pois as interações do tipo dipolo induzido-dipolo induzido vão se tornando mais intensas em cadeias mais longas.

As interações entre moléculas de hidrocarbonetos também impactam a densidade. Como essas interações não são tão fortes, as moléculas costumam ficar mais espaçadas e, por conta disso, os hidrocarbonetos possuem uma densidade menor que a da água, cujo valor é de 1,0 g/cm³.
Quanto à reatividade, os hidrocarbonetos podem sofrer diversos tipos de reação, como de adição, oxidação, redução e substituição. Entretanto, os alcanos, os aromáticos e cicloalcanos com mais de seis carbonos são os hidrocarbonetos mais estáveis e, por isso, menos reativos que os demais.
Para explicar essa estabilidade, deve-se levar em consideração que os alcanos possuem apenas ligações do tipo σ (sigma), as quais são as mais fortes. Já os compostos aromáticos são sempre estabilizados pelo efeito de ressonância, o qual diminui a repulsão dos elétrons na estrutura. Já os cicloalcanos com pelo menos seis carbonos conseguem ter o ângulo de ligação entre carbonos de 109° 28’, o qual garante estabilidade por minimizar as repulsões entre elétrons. Para que consigam tais ângulos, os carbonos ficam em planos diferentes, distorcendo a molécula.
Veja também: Propriedades da matéria no Enem: como esse tema é cobrado?
Nomenclatura dos hidrocarbonetos
Todos os compostos orgânicos seguem a nomenclatura oficial estabelecida pela União Internacional de Química Pura e Aplicada (Iupac). A Iupac determina que todo hidrocarboneto deve possuir sufixo –o.
Para dar o nome de um hidrocarboneto, deve-se:
-
identificar a cadeia principal;
-
determinar a posição das insaturações (se houver);
-
determinar a posição de ramificações (se houver);
Posteriormente, o nome, de forma geral, possuirá a seguinte estrutura:
posição e nome das ramificações em ordem alfabética + nome da cadeia principal
O nome da cadeia principal é dividido sempre em três partes:
-
prefixo: o qual indica o número de átomos de carbono;
-
infixo: o qual identifica se a cadeia possui apenas ligações simples (-an-) ou a presença de ligações duplas (-en-) ou triplas (-in-);
-
sufixo: o qual identifica a função orgânica. Como antes dito, no caso dos hidrocarbonetos, é sempre –o.
Sobre os prefixos, vale lembrar que, até quatro carbonos, eles são:
-
met- para um carbono;
-
et- para dois carbonos;
-
prop- para três carbonos;
-
but- para quatro carbonos.
Para cinco carbonos ou mais, deve-se utilizar os prefixos derivados do grego (pent-, hex-, hept-, oct-…).
Já as ramificações recebem os mesmos prefixos das cadeias carbônicas, mais o sufixo –il ou –ila, sem a necessidade do infixo.
-
Alcanos
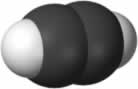
O hidrocarboneto mais simples que existe é o alcano de nome metano, de fórmula molecular CH4 e principal constituinte do gás natural.
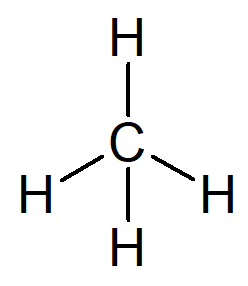
Seu nome pode ser construído a partir do seguinte raciocínio:
-
O prefixo para uma estrutura orgânica que só possui um carbono é met–.
-
O infixo para uma estrutura orgânica que só apresenta ligações simples entre carbonos é –an–.
-
O sufixo para todo hidrocarboneto é –o.
Outro alcano de grande importância é o butano, de fórmula C4H10, presente no gás liquefeito de petróleo, GLP.
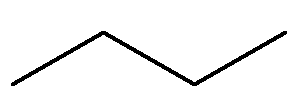
Para entender o nome butano:
-
O prefixo para uma estrutura orgânica que possui quatro carbonos é but.
-
O infixo para uma estrutura orgânica que só apresenta ligações simples entre carbonos é –an–.
-
O sufixo para todo hidrocarboneto é –o.
Quando o alcano é ramificado, deve-se numerar e nomear todas as ramificações. O exemplo abaixo é o do 2,2,4-trimetil-pentano, principal constituinte da gasolina. A cadeia principal está identificada e numerada conforme as recomendações da Iupac: a cadeia principal é a maior cadeia seguida dentro da estrutura, começando-se a partir de um carbono da extremidade, sem saltos entre eles. Já as ramificações devem estar sempre nas posições de menor número possível, mas nunca nas extremidades.
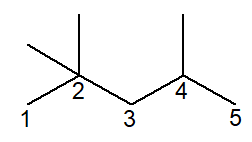
Seu nome é justificado da seguinte forma:
-
A Iupac determina que, para cada ramificação, deve-se haver uma posição, mesmo que haja repetição. Percebe-se que foram identificadas três ramificações de um carbono, que são chamadas de “metil”. Há dois radicais metil na posição 2 e mais um na posição 4 da cadeia principal. Utilizamos o prefixo tri– na nomenclatura para indicar que tal ramificação se repete três vezes na estrutura.
-
A cadeia principal possui cinco carbonos, logo recebe o sufixo pent–, o infixo –an– e o sufixo de hidrocarboneto –o, ficando então pentano.
Leia mais: Nomenclatura de alcanos com mais de dez carbonos
-
Alcenos, alcinos e alcadienos
Hidrocarbonetos de cadeia aberta e insaturados, como os alcenos, alcinos e alcadienos, possuem as mesmas regras de nomenclatura dos alcanos, porém com um detalhe: a necessidade de identificar a insaturação no infixo.
Assim como as ramificações, as insaturações podem ocorrer em posições distintas da cadeia e, por isso, devem ter sua posição identificada no nome oficial da estrutura.
Outro ponto importante é de que as insaturações devem sempre estar na cadeia principal.
Veja o exemplo a seguir, que corresponde ao 4-etil-hex-2-eno.
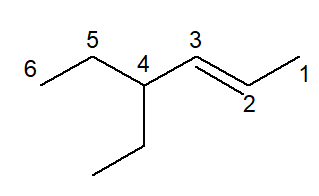
-
Quando uma cadeia possui a presença de ramificação e insaturação, pelas regras gerais da Iupac, a insaturação possui preferência sobre a ramificação e, sendo assim, deve possuir a posição de menor número. Por isso, a cadeia principal foi numerada da direita para a esquerda.
-
Com essa numeração, a ramificação, de dois carbonos (cujo nome é etil), ficou no carbono de número 4.
-
A ligação dupla está entre os carbonos 2 e 3, mas, no nome oficial, só se coloca a posição do carbono de partida da insaturação.
-
O nome 4-etil-hex-2-eno é entendido, então, assim: 4 é posição da ramificação etil, hex é o prefixo da cadeia principal, infixo 2-en para conter a posição da ligação dupla, e -o como sufixo do hidrocarboneto.
No segundo exemplo, temos o caso do pent-1-ino, um alcino.
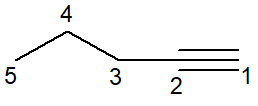
-
O carbono que realiza ligação tripla possui hibridização sp, portanto de geometria linear. Por isso, alguns autores têm adotado a fórmula bastão de forma linear para explicitar essa característica.
-
A ligação tripla está na ponta da cadeia e, assim, inicia a contagem da cadeia principal.
-
A estrutura recebe o prefixo pent-, o infixo 1-in, para conter a posição da ligação tripla, e -o como sufixo do hidrocarboneto.
Agora temos o caso de um alcadieno: o 4-metil-penta-1,3-dieno
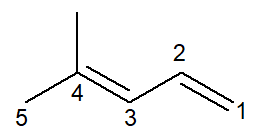
-
A nomenclatura é praticamente idêntica, com algumas adaptações: o prefixo é alterado de pent- para penta- como forma de melhorar a leitura.
-
Como há duas ligações duplas, deve-se numerar ambas no infixo, tanto a que começa no carbono de número 1 quanto a que começa no carbono de número 3. O prefixo di- também é utilizado para indicar no nome que há duas ligações duplas.
-
Assim, inicia-se por 4-metil por ser a ramificação, depois o prefixo penta-, mais o infixo 1,3-dien contendo as posições das duas duplas ligações e mais o sufixo de hidrocarboneto –o.
-
Cicloalcanos e cicloalcenos
Tanto cicloalcanos quanto cicloalcenos possuem as mesmas regras de nomenclatura dos hidrocarbonetos respectivos de cadeia aberta, alcanos e alcenos.
A única diferença é que se deve iniciar o nome da cadeia principal com o prefixo ciclo-, como nos exemplos a seguir:

-
A estrutura acima é conhecida como ciclobutano, pois é um cicloalcano de quatro carbonos.
-
Recebe o prefixo ciclobut-, pois possui quatro carbonos e é fechada.
-
O infixo –an– para indicar que todas as ligações entre carbonos são simples.
-
O sufixo –o para indicar que é um hidrocarboneto.
Abaixo temos a estrutura do 3-metil-ciclopenteno:
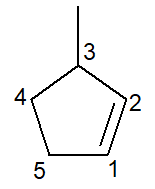
-
No caso de cicloalcenos, o carbono de número 1 sempre será o que inicia a ligação dupla.
-
A ramificação deve receber o menor número possível como dito anteriormente e, por isso, a numeração seguiu sentido anti-horário.
-
3-metil, pois, no carbono de número 3, há uma ramificação do tipo metil; ciclopent-, pois é um cicloalceno de cinco carbonos; infixo –en–, para indicar a presença da ligação dupla (nesse caso, não há necessidade do número 1, pois é redundante), mais o sufixo –o de hidrocarboneto.
-
Aromáticos
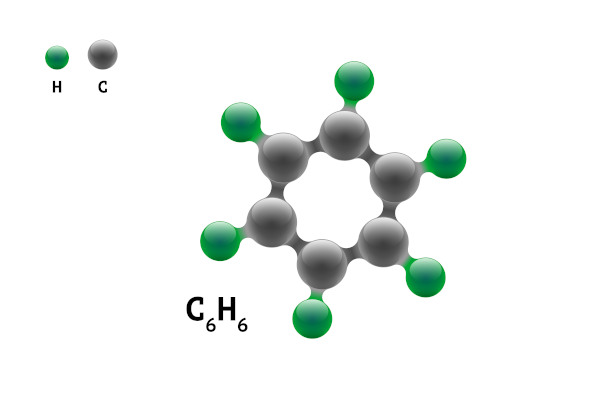
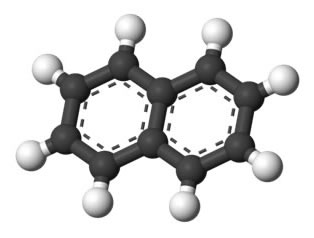
Os hidrocarbonetos aromáticos possuem nome próprio, como o caso do benzeno e naftaleno, representados abaixo.
→ Benzeno
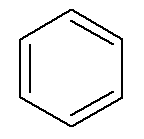
→ Naftaleno
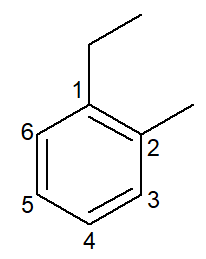
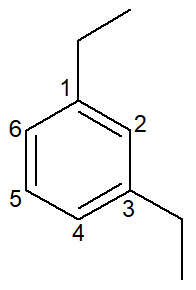
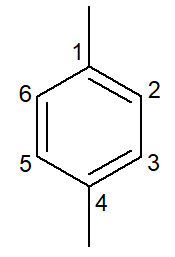
Nesse caso, seus próprios nomes são também os nomes das suas respectivas cadeias principais. O benzeno possui as mesmas regras de nomenclatura e numeração que os cicloalcanos e cicloalcenos de uma maneira geral, entretanto, quando possuem duas ramificações, podem apresentar a possibilidade dos prefixos orto-, meta- e para- para designar a posição dessas ramificações.
|
Estrutura |
Nomenclatura oficial |
Nomenclatura oficial alternativa |
|
|
1-etil-2-metil-benzeno |
orto-etil-metil-benzeno |
|
|
1,3-dietil-benzeno |
meta-dietil-benzeno |
|
|
1,4-dimetil-benzeno |
para-dimetil-benzeno |
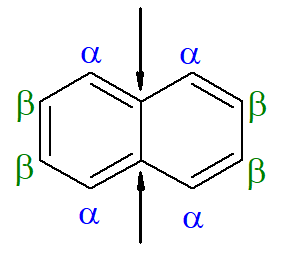
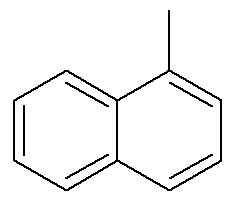
Já para o naftaleno, a imagem anterior mostra uma indicação alternativa e tradicional para suas posições. Os carbonos de interseção dos anéis aromáticos, indicados pelas setas, são os carbonos de referência. O primeiro carbono vizinho ao carbono de referência, seja à esquerda, seja à direita, é chamado de carbono α. Já o segundo carbono vizinho ao carbono de referência, seja à esquerda, seja à direita, é chamado de carbono β. A estrutura a seguir é a do α-metil-naftaleno
Veja também: Benzopireno — um composto aromático cancerígeno
Onde se encontram os hidrocarbonetos?
Os hidrocarbonetos ocorrem naturalmente no petróleo e de lá são extraídos por meio do refino desse produto, em processos como a destilação fracionada, a reforma catalítica e o craqueamento.
Alguns hidrocarbonetos mais leves, como o metano, também ocorrem no gás natural, que existe no subsolo terrestre e é oriundo da decomposição anaeróbia da matéria orgânica.
O metano, em específico, também pode ser gerado na decomposição de resíduos orgânicos de aterros sanitários e lixões, assim como é produto da digestão de alguns animais. Além disso, ainda pode ocorrer naturalmente em ecossistemas, como pântanos.
O gás eteno ocorre naturalmente em plantas e é o responsável pelo amadurecimento de frutas.
Função dos hidrocarbonetos
Os hidrocarbonetos possuem utilização distinta e variada. Seu principal uso é do ponto de vista energético, pois boa parte deles é utilizada como combustível, como no caso do gás natural, do gás liquefeito de petróleo (GLP), da gasolina e do diesel.
Também são importantes na indústria de plástico, pois geram importantes polímeros, como o polietileno, o polipropileno e o poliestireno, os quais são usados para fabricar diversos recipientes, invólucros e filmes plásticos, além de isopor.
Os hidrocarbonetos também são importantes na indústria química, pois podem ser utilizados como solventes, como é o caso do hexano, ou até mesmo como estruturas químicas básicas para a síntese de compostos mais complexos, como é o caso do benzeno.
Infelizmente também estão associados a problemas ambientais. A queima de combustíveis à base de hidrocarbonetos gera um aumento de dióxido de carbono na atmosfera, um gás-estufa. Já os plásticos são persistentes no meio ambiente e não se degradam facilmente e, por isso, políticas públicas têm sido criadas ao redor do mundo para um maior consumo consciente. No Brasil, por exemplo, algumas cidades já proíbem a utilização de canudos plásticos e não permitem a livre distribuição de sacolas plásticas nos supermercados.
Exercícios resolvidos
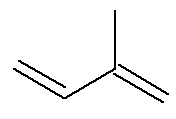
Questão 1 - (IME-RJ 2007) O isopreno é um composto orgânico tóxico que é utilizado como monômero para a síntese de elastômeros, através de reações de polimerização. Dada a estrutura do isopreno, qual sua nomenclatura IUPAC?
-
1,3-buteno
-
2-metil-butadieno
-
2-metil-buteno
-
pentadieno
-
3-metil-butadieno
Resolução
Alternativa E.
Para determinar a nomenclatura Iupac desse composto, que é um alcadieno, deve-se identificar, em primeiro momento, a sua cadeia principal.
A cadeia principal deve conter as duas ligações duplas e ser a maior cadeia sequencial possível. Já a numeração da cadeia principal deve ocorrer de forma que as insaturações e a ramificação fiquem com o menor número possível. Abaixo temos a cadeia principal contada corretamente:
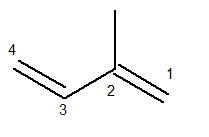
O radical metil ficou então na posição 2. Já as ligações duplas estão nas únicas posições possíveis para esse composto, ou seja, nas posições 1 e 3.
Sendo assim, o nome dessa estrutura, segundo a Iupac, é 3-metil-butadieno.
Não há a necessidade de escrever butan-1,3-dieno, pois seria redundante.
O gabarito, então, é letra E.
Questão 2 – (UERJ 2015) Um processo petroquímico gerou a mistura, em partes iguais, dos alcinos com fórmula molecular C6H10. Por meio de um procedimento de análise, determinou-se que essa mistura continha 24 gramas de moléculas de alcinos que possuem átomo de hidrogênio ligado a átomo de carbono insaturado.
A massa da mistura, em gramas, corresponde a:
A) 30
B) 36
C) 42
D) 48
Resolução
Alternativa C.
Existem diversos alcinos possíveis com fórmula molecular C6H10.
Nessa questão, informa-se que todos os alcinos possíveis com essa fórmula compõem uma mistura e que apenas as moléculas de alcinos que possuem átomo de hidrogênio ligado a átomo de carbono insaturado são responsáveis por 24 gramas dessa mistura.
Carbono insaturado em um alcino é o que faz ligação tripla. Como cada átomo de carbono só é capaz de fazer quatro ligações, para que se tenha hidrogênio ligado a um carbono com ligação tripla, é necessário que essa ligação tripla esteja no carbono da ponta.
Sendo assim, as estruturas possíveis com essa fórmula são (os hidrogênios ligados ao carbono insaturado estão destacados para melhor visualização):
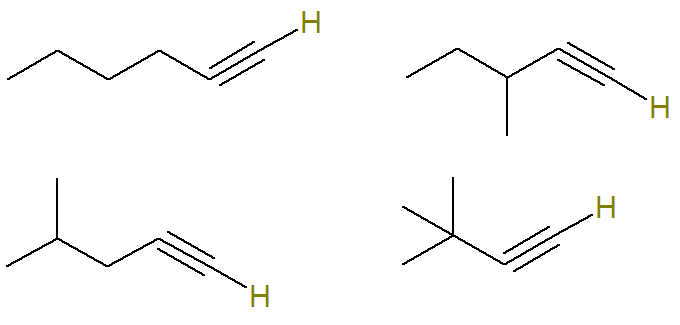
Já os alcinos de fórmula C6H10 que não obedecem a esse critério são:
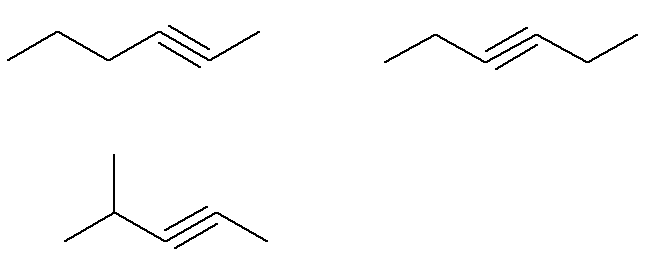
Ou seja, ao todo, existem sete alcinos com fórmula C6H10 (quatro que obedecem ao critério e mais três que não obedecem). Assim, com uma simples regra de três, podemos saber a massa total da mistura:
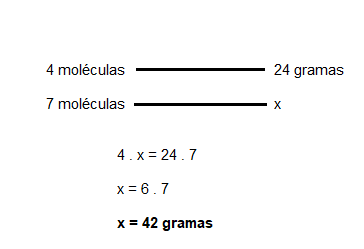
Sendo assim, o gabarito para essa questão é letra C.