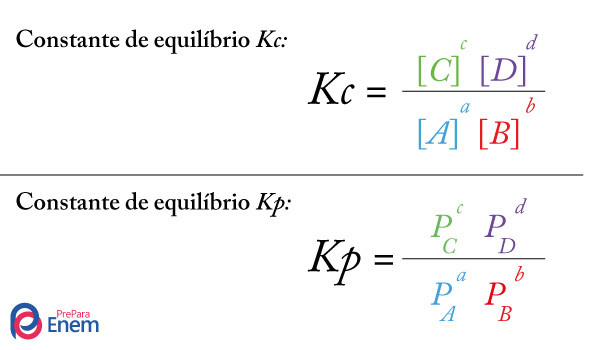O químico Friedrich Wilhelm Ostwald (1853-1932), nascido na Letônia, estudou bastante os equilíbrios iônicos e foi o primeiro cientista a relacionar o grau de ionização ou de dissociação (α) de monoácidos e monobases, com a concentração em mol/L (M) e com a constante de ionização ou de dissociação (Ki). Baseado em seus estudos, ele criou a seguinte lei:
Lei de diluição de Ostwald: Numa dada temperatura, à medida que a concentração em mol/L de um dado eletrólito diminui, o seu grau de ionização ou dissociação aumenta, ou seja, eles são inversamente proporcionais.
Para você entender como ele chegou a essa conclusão e quais as fórmulas que relacionam essas grandezas nos equilíbrios iônicos, vamos pegar um exemplo. Consideremos que determinado ácido genérico, representado por HA, seja dissolvido em certo volume de água, gerando os íons H+ e A-. Veja como isso ocorre:
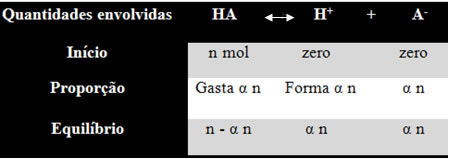
A constante de ionização para o equilíbrio acima é dada por:
Ki = [H+] . [A-]
[HA]
Sabemos que a concentração em quantidade de matéria (M) é em mol/L, assim, vamos relacionar o número de mol de cada espécie acima (do ácido e dos íons) com o volume da solução para sabermos as concentrações:
M = [ ] → Vamos usar os colchetes porque na fórmula da constante de ionização a concentração das espécies é representada assim.
[HA] = n- α n [H+] = α n [A-] = α n
V V V
[HA] = n (1 – α)
V
Agora, vamos pegar esses valores e substituir na expressão da constante de ionização para o equilíbrio acima:
Ki = [H+] . [A-]
[HA]
α n α n
Ki = V . V
n (1 – α)
V
α . α . n
Ki = V
1- α
Ki = α2 . n
1- α V
Sabemos que n/V é igual à concentração em mol/L (M), então, temos:
Ki = α2 . M
1- α
Observe que essa fórmula mostra o que a lei de Ostwald, mencionada no início, diz sobre a concentração e o grau de ionização ou dissociação serem inversamente proporcionais, portanto, se um aumenta, o outro diminui.
Ki = ↑ α2 . M↓
1- α
Isso é verdade, pois imagine que diluíssemos a solução, acrescentando mais água, isso iria fazer com que a concentração em mol-L diminuísse. Com isso, o grau de ionização ou dissociação iria aumentar porque o eletrólito iria dissolver mais.
Ki é uma constante, que só irá ser alterada com a mudança da temperatura. Isso significa que em uma temperatura fixa o produto α2 . M é constante.
Outro fator importante é que, no caso de ácidos e bases fracos ou sais pouco solúveis, em que o α é baixo, podemos considerar que 1 – α é aproximadamente igual a 1. Substituindo (1 – α) por 1 na equação de Ki acima, temos:
Ki = α2 . M
Essa é a expressão usada no caso de eletrólitos fracos.