A ligação covalente é um tipo de ligação química que mantém as moléculas unidas por meio da atração mútua entre os núcleos dos átomos envolvidos e a nuvem eletrônica compartilhada. É formada pela diferença de eletronegatividade entre os átomos que compõem a ligação. Além disso, as ligações covalentes determinam muitas propriedades das substâncias, como ponto de ebulição, ponto de fusão, solubilidade e reatividade química.
Leia também: Diferenças entre compostos covalentes e moleculares
Tópicos deste artigo
- 1 - Resumo sobre ligação covalente
- 2 - Videoaula sobre ligação covalente
- 3 - O que é a ligação covalente?
- 4 - Exemplos de ligação covalente
- 5 - Características da ligação covalente
- 6 - Como ocorre a ligação covalente?
- 7 - Quais os tipos de ligação covalente?
- 8 - Diferenças entre ligações covalente, iônica e metálica
- 9 - Exercícios resolvidos sobre ligação covalente
Resumo sobre ligação covalente
-
Ligação covalente envolve o compartilhamento de elétrons entre átomos.
-
Ocorre principalmente entre átomos não metálicos.
-
Os elétrons de valência são compartilhados para alcançar estabilidade eletrônica.
-
Forma moléculas e compostos covalentes.
-
As ligações covalentes podem ser simples, duplas ou triplas.
-
As propriedades físicas das substâncias covalentes incluem baixos pontos de fusão e ebulição.
-
As substâncias covalentes são, geralmente, insolúveis em água.
-
Podem ser polares ou apolares, dependendo da diferença de eletronegatividade dos átomos envolvidos.
-
As moléculas covalentes podem ter geometrias diferentes com base nos ângulos de ligação.
-
As ligações covalentes são mais flexíveis e menos rígidas em comparação com as ligações iônicas ou metálicas.
Videoaula sobre ligação covalente
O que é a ligação covalente?
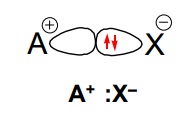
A ligação covalente é um tipo de ligação química que ocorre quando dois átomos compartilham elétrons de valência para alcançar uma configuração eletrônica mais estável. Nesse tipo de ligação, os átomos não doam nem recebem elétrons, mas sim os compartilham de forma que ambos os átomos tenham acesso a uma configuração eletrônica mais próxima da configuração de um gás nobre.
Exemplos de ligação covalente
-
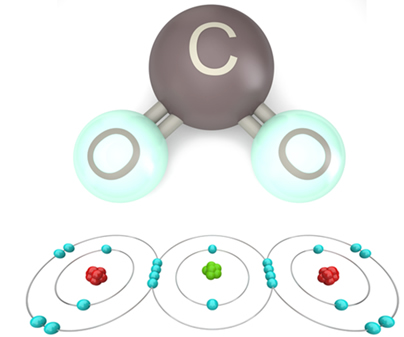
Ligação covalente no dióxido de carbono (CO2): No dióxido de carbono, dois átomos de oxigênio compartilham dois pares de elétrons com um átomo de carbono. Essa ligação ocorre porque o oxigênio e o carbono têm alta afinidade eletrônica e compartilham elétrons para alcançar uma configuração eletrônica mais estável.
![Molécula de CO2 formada pelo compartilhamento de elétrons entre dois átomos de oxigênio e um de carbono.[2]](https://static.preparaenem.com/2023/07/ligacao-covalente-dioxido-carbono.jpg)
-
Ligação covalente na água (H2O): Na molécula de água, dois átomos de hidrogênio compartilham um par de elétrons com um átomo de oxigênio. A ligação ocorre porque o hidrogênio e o oxigênio têm alta eletronegatividade e compartilham elétrons para preencher suas camadas de valência.
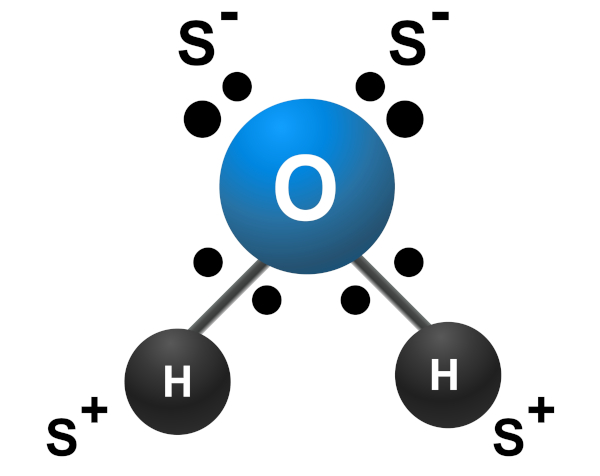
-
Ligação covalente no etano (C2H6): No etano, dois átomos de carbono compartilham um par de elétrons entre si, e cada carbono também está ligado a três átomos de hidrogênio, compartilhando um par de elétrons. Isso ocorre porque os átomos de carbono compartilham elétrons para preencher suas camadas de valência e alcançar uma configuração eletrônica mais estável.
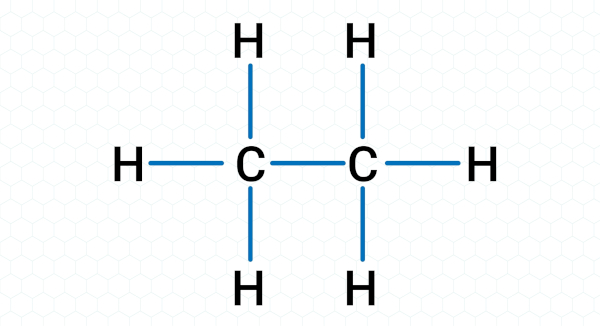
-
Ligação covalente no oxigênio molecular (O2): No oxigênio molecular, dois átomos de oxigênio compartilham dois pares de elétrons entre si. A ligação ocorre porque ambos os átomos de oxigênio têm alta afinidade eletrônica e compartilham elétrons para alcançar uma configuração eletrônica mais estável, preenchendo suas camadas de valência.
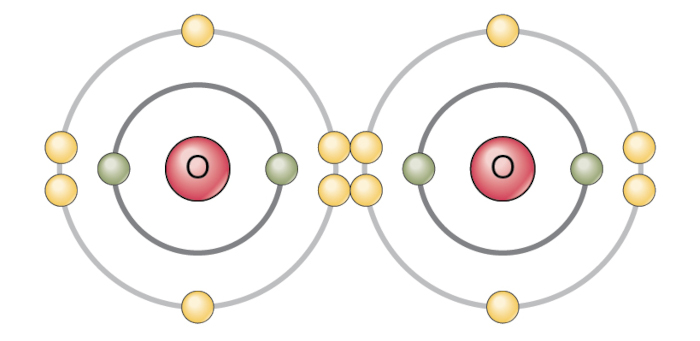
Em todos esses exemplos, a ligação covalente ocorre porque os átomos envolvidos têm uma tendência a compartilhar elétrons para alcançar uma configuração eletrônica mais estável, preenchendo suas camadas de valência E alcançando a configuração eletrônica de um gás nobre. O compartilhamento de elétrons permite que os átomos fiquem mais estáveis energeticamente, resultando na formação de moléculas covalentes.
Leia também: Por que os átomos precisam realizar ligações para ficar estáveis?
Características da ligação covalente
-
Átomos não metálicos: Geralmente ocorrem entre átomos não metálicos (ametais) que possuem alta afinidade eletrônica e tendência de atrair elétrons. Exemplos comuns de ametais são carbono, oxigênio, hidrogênio, nitrogênio e flúor.
-
Formação de moléculas: A ligação covalente é responsável pela formação de moléculas nas quais os átomos estão unidos por meio do compartilhamento de elétrons. Cada molécula é uma entidade química independente e possui propriedades características.
-
Forças de atração intermoleculares: Nas ligações covalentes, as forças de atração intermoleculares são relativamente fracas se comparadas às ligações iônicas. Essas forças são resultantes das interações entre as nuvens eletrônicas compartilhadas e afetam propriedades como ponto de ebulição e solubilidade.
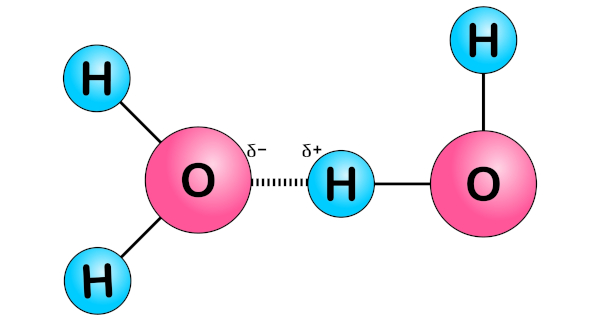
-
Polaridade das ligações: Podem apresentar caráter polar ou apolar, dependendo da diferença de eletronegatividade dos átomos ligantes. Esse é o caso do HCl, em que a eletronegatividade do Cl é 3,6, enquanto a do H é 2,2. Sendo assim, o átomo de cloro atrai mais fortemente os elétrons da ligação para a sua eletrosfera, fazendo com que os átomos adquiram carga parciais, negativa (Cl) e positiva (H), gerando um dipolo permanente. Dessa forma, a molécula de HCl pode ser classificada como apolar. Para saber mais sobre a polaridade das ligações, clique aqui.
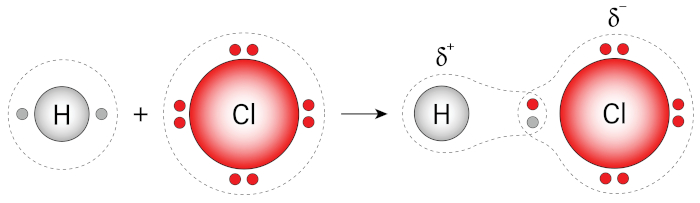
-
Energia de ligação: A formação de uma ligação covalente está associada a uma energia de ligação, que representa a energia necessária para quebrar essa ligação. Essa energia varia dependendo dos átomos envolvidos e do tipo de ligação covalente.
-
Flexibilidade e direcionalidade: As ligações covalentes são relativamente flexíveis, permitindo a rotação de grupos de átomos ao redor da ligação. Além disso, elas podem ter direcionalidade, influenciando a forma tridimensional das moléculas.
-
Estabilidade da ligação: A ligação covalente é mantida pela atração eletrostática entre os núcleos dos átomos envolvidos e a nuvem eletrônica compartilhada. Quanto mais forte for a atração entre os elétrons compartilhados e os núcleos, mais estável será a ligação covalente.
Como ocorre a ligação covalente?
Os átomos envolvidos na ligação covalente são geralmente átomos de ametais que têm uma alta afinidade eletrônica, ou seja, uma tendência de atrair elétrons. Os elétrons de valência desses átomos se sobrepõem e são compartilhados entre eles, criando uma nuvem eletrônica compartilhada ao redor dos átomos envolvidos na ligação. Essa nuvem eletrônica é o resultado da combinação dos orbitais atômicos dos átomos envolvidos.
Para entender como ocorre essa ligação, é necessário compreender alguns conceitos importantes:
-
Orbitais atômicos: Os elétrons em um átomo são distribuídos em diferentes orbitais ao redor do núcleo. Cada orbital pode abrigar um ou dois elétrons com spins opostos. Os orbitais mais externos, chamados de orbitais de valência, são os responsáveis pela formação de ligações químicas.
-
Sobreposição de orbitais: Durante a ligação covalente, os orbitais atômicos dos átomos envolvidos se aproximam uns dos outros, o que permite a sobreposição deles. Isso ocorre quando os orbitais têm formas e orientações adequadas, o que possibilita que os elétrons sejam compartilhados.
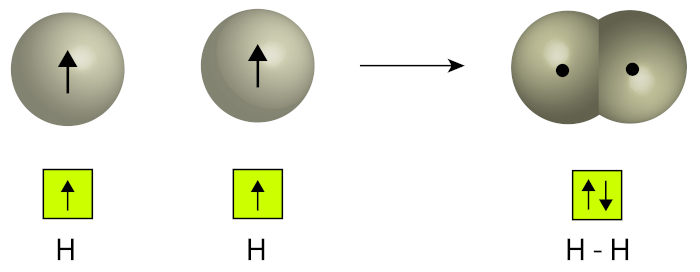
-
Formação da nuvem eletrônica compartilhada: Essa superposição dos orbitais cria uma região ao redor dos átomos envolvidos na ligação, conhecida como nuvem eletrônica compartilhada. Essa nuvem é formada pelos elétrons compartilhados pelos átomos. Cada elétron compartilhado pertence simultaneamente aos dois átomos, criando uma atração mútua entre eles.
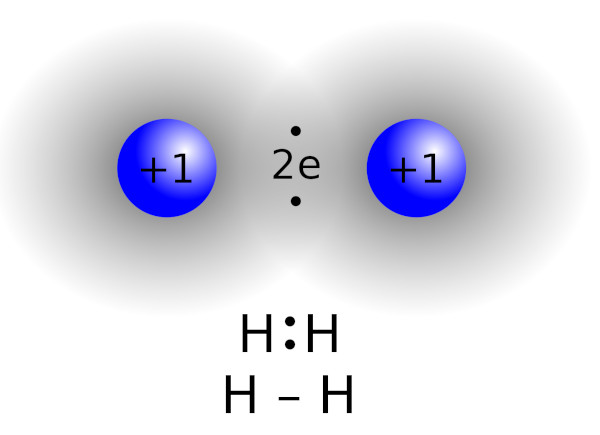
É importante ressaltar que, na ligação covalente, os elétrons são compartilhados de maneira desigual entre os átomos, dependendo da eletronegatividade de cada um. Átomos mais eletronegativos atraem mais fortemente os elétrons compartilhados, resultando em uma distribuição assimétrica de carga na molécula, criando polos positivos e negativos.
Leia também: Tipos de forças intermoleculares
Quais os tipos de ligação covalente?
Existem três principais tipos de ligação covalente: ligação covalente simples, ligação covalente dupla e ligação covalente tripla. Esses tipos diferem na quantidade de pares de elétrons compartilhados entre os átomos envolvidos.
-
Ligação covalente simples: Na ligação covalente simples, dois átomos compartilham um único par de elétrons. Essa é a forma mais comum de ligação covalente. Um exemplo é a molécula de H2, na qual dois átomos de hidrogênio compartilham um par de elétrons, preenchendo a camada de valência de cada átomo.
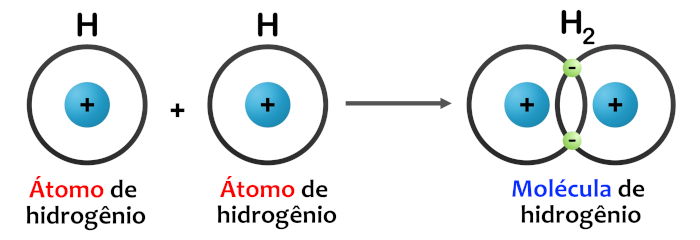
-
Ligação covalente dupla: Na ligação covalente dupla, dois pares de elétrons são compartilhados entre os átomos envolvidos. Isso ocorre quando dois átomos têm a necessidade de compartilhar mais elétrons para atingir uma configuração eletrônica estável. Um exemplo é a molécula de O2, em que dois átomos de oxigênio compartilham dois pares de elétrons com o carbono, formando duas ligações dupla.
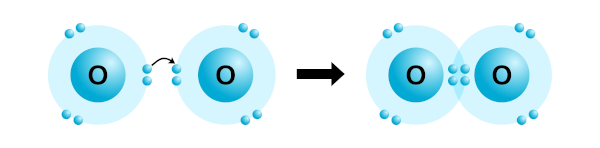
-
Ligação covalente tripla: Na ligação covalente tripla, três pares de elétrons são compartilhados entre os átomos envolvidos. Essa forma de ligação covalente é mais rara e ocorre quando dois átomos necessitam compartilhar três pares de elétrons para atingir a estabilidade eletrônica. Um exemplo é a molécula de N2, na qual dois átomos de nitrogênio compartilham três pares de elétrons, formando uma ligação tripla entre eles.
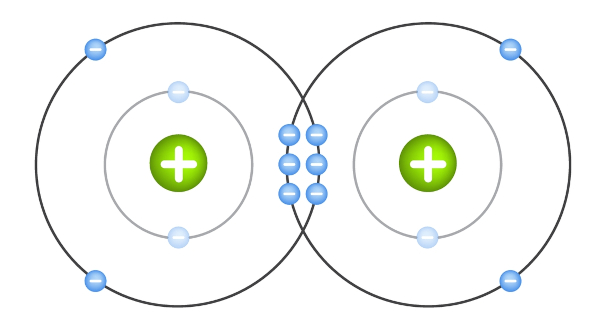
Além desses tipos, também existe a ligação covalente coordenada (ou dativa). Nesse caso, um átomo fornece ambos os elétrons do par compartilhado. É como se um átomo doasse os dois elétrons para a formação da ligação covalente. Esse tipo de ligação ocorre quando um átomo tem um par de elétrons não compartilhados e outro átomo precisa de um par de elétrons adicionais para formar uma ligação.
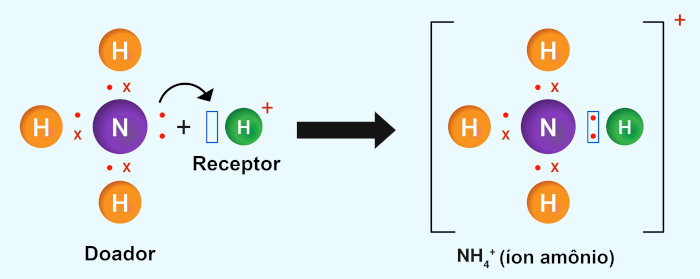
Diferenças entre ligações covalente, iônica e metálica
As diferenças entre ligações covalentes, iônicas e metálicas podem ser destacadas pela natureza do compartilhamento de elétrons.
-
Ligação covalente: Os elétrons de valência são compartilhados entre os átomos envolvidos na ligação. Essa ligação ocorre principalmente entre átomos não metálicos.
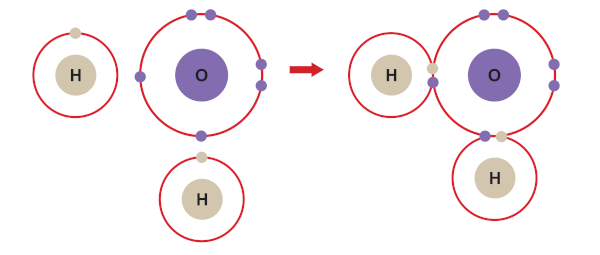
-
Ligação iônica: Os elétrons são transferidos de um átomo para outro, resultando na formação de íons positivos e negativos. Essa ligação ocorre entre átomos metálicos e não metálicos. Para saber mais sobre esse tipo de ligação, clique aqui.
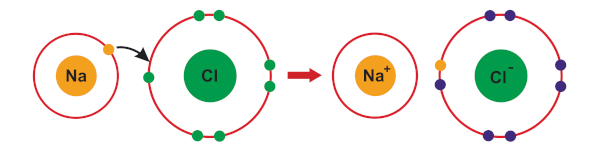
-
Ligação metálica: Os elétrons de valência são deslocalizados e compartilhados por todos os átomos de uma rede metálica, formando uma "nuvem eletrônica" em toda a estrutura metálica. Para saber mais sobre esse tipo de ligação, clique aqui.
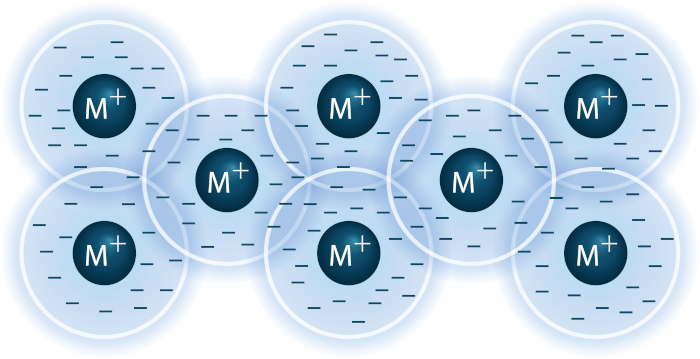
Essas são algumas das principais diferenças entre as ligações covalentes, iônicas e metálicas:
|
PRINCIPAIS DIFERENÇAS ENTRE OS TIPOS DE LIGAÇÕES QUÍMICAS |
|||
|
|
Covalente |
Iônica |
Metálica |
|
Tipo de substâncias formadas |
Moléculas e compostos covalentes |
Compostos iônicos |
Metais sólidos |
|
Ponto de fusão e ebulição |
Geralmente baixos |
Geralmente altos |
Variáveis, mas geralmente altos
|
|
Solubilidade em água |
Geralmente insolúveis |
Geralmente solúveis |
Insolúveis
|
|
Eletronegatividade |
Semelhante ou próxima |
Significativamente diferente |
Fator não determinante |
|
Condutividade |
Geralmente isolantes ou semicondutores |
Condutores quando em solução aquosa ou fundida |
Bons condutores de eletricidade e calor |
Exercícios resolvidos sobre ligação covalente
Questão 1
Qual é o tipo de ligação covalente encontrada na molécula de dióxido de carbono (CO2)?
a) Ligação covalente simples.
b) Ligação covalente dupla.
c) Ligação covalente tripla.
d) Ligação covalente coordenada.
e) Ligação iônica.
Justificativa: Letra B. Os átomos de carbono e oxigênio apresentam valores de eletronegatividade próximos, o que significa que possuem a tendência de compartilhar elétrons. Além disso, o carbono faz quatro ligações, e cada átomo de oxigênio faz duas. Sendo assim, para completarem seus octetos, são realizadas duas duplas ligações do tipo carbono-oxigênio.
Questão 2
Qual das seguintes opções é uma característica dos compostos covalentes?
a) Formação de íons positivos e negativos.
b) Alta solubilidade em água.
c) Condução de eletricidade no estado sólido.
d) Ligações metálicas entre os átomos.
e) Compartilhamento de elétrons entre os átomos.
Justificativa: Letra e. As ligações covalentes, com compartilhamento de elétrons, caracterizam os compostos covalentes.
Créditos da imagem
[1] Wikimedia Commons (imagem recortada)
[2] Wikimedia Commons (imagem recortada)
[3] Wikimedia Commons (imagem recortada)
[4] Wikimedia Commons (imagem recortada)
Fontes
DEXTER, R. Chemical bonding and structure. In: IB Chemistry Revision Guide. [s.l.] Anthem Press, 2019. p. 24–48.
DUARTE, H. A. Ligações Químicas: Ligação Ionica, Covalente e Metálica. Cadernos Temáticos de Química Nova na Escola, p. 4, 2001.
FELTRE, R. Química Geral. 6. ed. São Paulo: Moderna, 2004. v. 1
MUSA, U. Constructing models in teaching of chemical bonds: Ionic bond, covalent bond, double and triple bonds, hydrogen bond and molecular geometry. Educational Research and Reviews, v. 10, n. 4, p. 491–500, 23 fev. 2015.