No cotidiano, quando vamos comprar determinados produtos, tais como ovos e bananas, isso é feito usando um “conjunto” ou “porção” que normalmente é a dúzia. A dúzia equivale a 12 unidades do produto. Em diversas ocasiões esse tipo de compra se faz necessário. Por exemplo, 1 resma de papel contém 500 unidades, 1 milheiro de tijolos contém 1000 unidades e uma grosa de lápis contém 144 unidades.
Na Química acontece um raciocínio semelhante quando se trabalha com o aspecto quantitativo de átomos, moléculas, fórmulas, íons e elétrons. Estes são tão minúsculos que é impossível mensurar numa balança a massa deles individualmente. Por exemplo, sabemos que a massa atômica do átomo de hidrogênio é aproximadamente igual a 1 u, um valor que não tem como trabalharmos, por ser tão pequeno.
Visto que os químicos precisavam de uma quantidade de matéria que pudesse ser “pesada”, eles passaram a trabalhar com porções ou conjuntos de matéria, cuja massa pudesse ser medida. Além disso, essa “porção” deveria ser proporcionalmente constante em relação aos valores das massas atômicas dos elementos.
Assim, no ano de 1826, o químico alemão Wilhelm Ostwald (1853-1932) introduziu o conceito de mol.

?
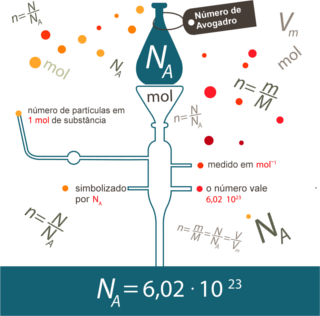
Mol é tanto o nome da unidade quanto do símbolo da unidade da quantidade de matéria. O nome pode ser pronunciado no singular e no plural, mas a unidade só é mencionada no singular. Por exemplo: “Quantos mols (nome no plural) tem 80 g de cálcio? Resposta: Em 40 g de cálcio há 2 mol (símbolo no singular). ”
Assim como em 1 dúzia existem 12 unidades, independentemente do produto, temos que:
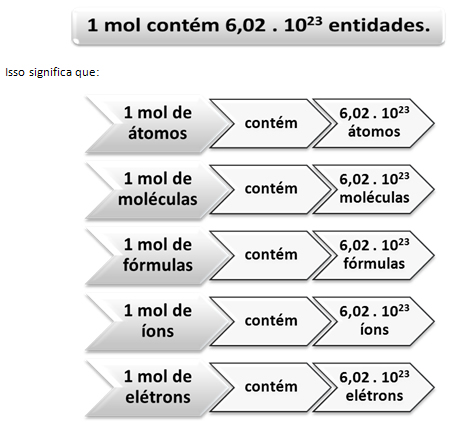
Esse é o valor da Constante de Avogadro que atualmente é confirmada por diversos métodos experimentais.
Mas, qual é a massa de 1 mol de matéria? Isso é mostrado pela massa molar:

A massa molar estabelece uma proporção constante entre os valores de massas atômicas dos elementos. Por exemplo, a massa atômica do oxigênio é 16 u, portanto, a massa molar do oxigênio é 16 g/mol.
O mesmo vale para moléculas ou fórmulas. Para exemplificar continuemos usando o caso do oxigênio. O gás oxigênio (O2) possui massa atômica igual a 32 u (2 . 16 u); assim, a massa molar desse gás é igual a 32 g/mol.
Para determinarmos a quantidade de matéria (n), isto é, quantos mols existem numa determinada massa de um elemento químico ou de uma substância, basta usarmos regras de três ou a seguinte fórmula matemática:
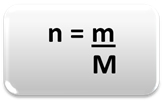
Onde:
n = quantidade de matéria (em mol);
m = massa dada (em gramas);
M = massa molar (em g/mol)
Dessa forma podemos determinar também quantas entidades químicas constituem a amostra (quantos átomos, por exemplo).
Exemplo:
Com respeito a uma amostra de 88 g de dióxido de carbono (CO2) determine:
a)Quantas moléculas existem nessa amostra?
b)Determine o número de mol.
Dados: Massas atômicas: C = 12 u, O = 16 u.
Resolução:
a)Primeiro temos que determinar a massa molar do dióxido de carbono:
M(CO2) = 12 + 2 . 16 = 44 g/mol
Sabendo que em 1 mol de CO2 temos 44 g, podemos usar uma regra de três:
44 g ------ 6,022 . 1023 moléculas
88 g ------ x
x = 1,2 . 1024 moléculas
Em 88 g temos 1,2 . 1024 moléculas de dióxido de carbono (CO2).
b)Podemos usar uma regra de três ou a fórmula. Veja as duas formas:
1º Método: regra de três 2º Método: Fórmula
1 mol ------- 44 g n = m
n ------------ 88g M
n = 88 n = 88
44 44
n = 2 n = 2
88 g gramas é a massa que contém 2 mol de dióxido de carbono (CO2).
Aproveite para conferir as nossas videoaulas relacionadas ao assunto: