Uma mistura de soluções que apresentam o mesmo soluto, como o próprio nome indica,
é aquela em que a substância que está dissolvida no solvente de cada uma das soluções é a mesma. É o caso, por exemplo, da mistura da solução de NaCl (cloreto de sódio) com outra também de NaCl.
Observação.: Quando misturamos soluções de mesmo soluto, elas também possuem o mesmo solvente.
Como as misturas de soluções de mesmo soluto possuem o mesmo soluto e solvente, ocorrem alterações na massa do soluto e no volume da solução resultante, como na representação a seguir:
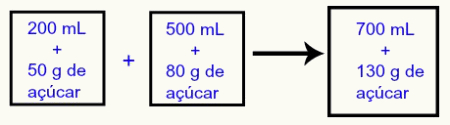
Ao adicionar as duas soluções em um único recipiente, forma-se uma nova solução com 700 mL e 130 gramas de açúcar. Com isso, podemos definir que, sempre que misturamos duas ou mais soluções com o mesmo soluto, podemos:
a) Somar as massas ou o número de mols do soluto presente em ambas para definir a massa e o número de mols do soluto resultante.
m1f = m1' + m1''
n1f = n1' + n1''
-
m1f = é a massa do soluto da solução resultante ou final;
-
m1' = é a massa do soluto da solução número 1;
-
m1'' = é a massa do soluto da solução número 2;
-
n1f = é o número de mols do soluto da solução resultante ou final;
-
n1' = é o número de mols do soluto da solução número 1;
-
n1'' = é o número de mols do soluto da solução número 2.
b) Somar o volume presente em ambas para definir o volume resultante.
Vf = V1 + V2
-
Vf = é o volume da solução resultante ou final;
-
V1 = é o volume da solução número 1;
-
V2 = é o volume da solução número 2.
c) Encontrar a concentração da solução final
O cálculo da concentração comum e da concentração molar (molaridade) de uma solução é realizado pelas seguintes fórmulas:
C = m1 ou M = n1
V V
Isolando a massa do soluto em ambas as fórmulas, teremos:
m1 = C.V ou n1 = M.V
Assim, podemos criar fórmulas envolvendo a concentração para cada uma das soluções envolvidas na mistura:
-
Mistura 1:
m1 = C1.V1 ou n1 = M1.V1
-
C1= concentração comum da solução 1;
-
M1= concentração molar (molaridade) da solução 1;
-
V1= Volume da solução 1.
-
Mistura 2:
m1 = C2.V2 ou n2 = M2.V2
-
C2= concentração comum da solução 2;
-
M2= concentração molar (molaridade) da solução 2;
-
V2= Volume da solução 2.
Aplicando na fórmula referente à mistura de soluções, temos:
Cf.Vf = C1.V1 + C2.V2
ou
Mf.Vf = M1.V1 + M2.V2
Exemplo 1: Uma solução que apresenta 400 gramas de NaCl dissolvidos em 1500 mL de solução é misturada à outra solução que possui 250 gramas de NaCl dissolvidos em 850 mL de água. Qual é o volume e a massa do soluto da solução final?
O enunciado fornece:
m1' = 400g
V1= 1500mL
m1” = 250g
V2= 850mL
Para o soluto da solução resultante:
m1f = m1' + m1''
m1f = 400 + 250
m1f = 650 gramas
Para o volume resultante:
Vf = V1 + V2
Vf = 1500 + 850
Vf = 2350 mL
Exemplo 2: Uma solução que apresenta 0,4 g/L de C6H12O6 dissolvidos em 150 mL de solução é misturada à outra solução que possui 0,2 g/L de C6H12O6 dissolvidos em 50 mL de água. Qual é o volume e a concentração da solução final?
O enunciado fornece:
C1 = 0,40g/L
V1= 150mL
C2 = 0,2g/L
V2= 50mL
Para o volume resultante (volume final):
Vf = V1 + V2
Vf = 150 + 50
Vf = 200 mL
Para a concentração comum resultante:
Cf.Vf = C1.V1 + C2.V2
Cf.200 = 0,4.150 + 0,2.50
Vf.200= 60 + 10
Vf.= 70
200
Vf= 0,35 g/L
Aproveite para conferir nossa videoaula relacionada ao assunto: