Para entendermos o que é uma ponte salina e a sua função em uma pilha, vamos voltar primeiramente ao esquema da Pilha de Daniell que será mostrado a seguir. Veja que ela é formada por um eletrodo positivo (cátodo) constituído de uma placa de cobre mergulhada em uma solução que contém íons cobre (Cu2+) e por um eletrodo negativo (ânodo) formado de zinco mergulhado em uma solução com íons zinco (Zn2+).
Com o passar do tempo, o zinco oxida-se, doando elétrons, e sua placa é corroída, formando mais íons Zn2+ em solução: Zn( s) ↔ Zn2+(aq) + 2 e-. Por outro lado, os íons Cu2+ da outra solução recebem os elétrons doados pelo zinco e são reduzidos, formando cobre metálico que se deposita sobre a placa: Cu2+(aq) + 2 e- ↔ Cu( s). Visto que os cátions Cu2+ fornecem a cor azul da solução de sulfato de cobre e a concentração deles vai diminuindo na solução, a cor azul vai ficando menos intensa, indo para o incolor:
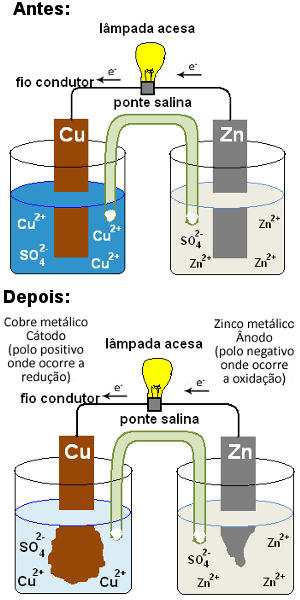
Pilha de Daniell depois de um tempo de funcionamento
Isso significa que, com o passar do tempo, haveria um momento em que a concentração dos íons zinco em solução ficaria muito grande e a concentração de cátions cobre ficaria muito baixa. Assim, ambos os eletrodos perderiam a neutralidade e a reação acabaria, a pilha pararia de funcionar.
É aí que surge a ponte salina. Ela existe para impedir que isso ocorra, para manter as duas semicelas eletricamente neutras. A ponte salina permite a migração dos íons entre as soluções dos eletrodos. Os ânions (íons negativos) migram para o ânodo e os cátions (íons positivos) migram para o cátodo, assim, a quantidade de cátions e de ânions na solução de cada eletrodo permanece em equilíbrio, prolongando o funcionamento da pilha.
As pontes salinas das pilhas geralmente são constituídas de um tubo em U (como o mostrado na imagem inicial) com uma solução concentrada de um sal bastante solúvel, como o cloreto de potássio (KCl), o sulfato de potássio (K2SO4) ou o nitrato de amônio (NH4NO3). As extremidades do tubo em U são fechadas com algodão ou ágar-ágar. Esse último é uma substância gelatinosa (será mostrada na figura a seguir) que é extraída de algas vermelhas e usada para fazer gelatina e também como meio de cultura em placas de Petri em laboratórios bacteriológicos.

O ágar-ágar é uma substância gelatinosa extraída de algas vermelhas e usada nas extremidades do tubo da ponte salina
As pontes salinas também podem ser substituídas por uma placa de porcelana porosa. A ponte salina usada na pilha de Daniell acima é um tubo em U com a solução de um sal. Se for o KCl, os seus ânions Cl-1 migrarão para a semicela em que há o excesso de cátions Zn2+, neutralizando-os. Já os cátions K+1 migrarão para a semicela com deficiência de cátions Cu2+, também neutralizando o meio.
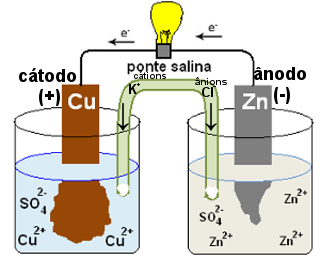
Esquema de funcionamento de uma ponte salina











