Cada metal possui uma capacidade própria de doar elétrons, diferente da capacidade de outros metais. Essa diferença de reatividade pode ser vista, por exemplo, ao compararmos a oxidação do ferro e a do ouro. O ferro se oxida facilmente com o ar, enferrujando ao longo do tempo; já o ouro dificilmente se oxida.
Por essa grande resistência às substâncias corrosivas, o ouro é indicado para obturações ou para implantes de dentes; pois ele resiste à corrosão de substâncias presentes na saliva. Além disso, sarcófagos das múmias dos faraós que datam de 1400 a.C. foram recobertos por ouro e podem ser vistos assim até hoje.
Isso também pode ser visualizado quando analisamos pilhas de diferentes metais. Por exemplo, observe duas pilhas diferentes em que se utiliza o mesmo eletrodo de cobre (placa de cobre mergulhada em um recipiente contendo uma solução de sulfato de cobre (CuSO4)):
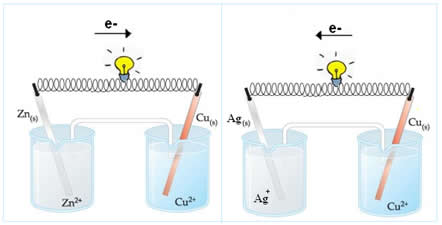
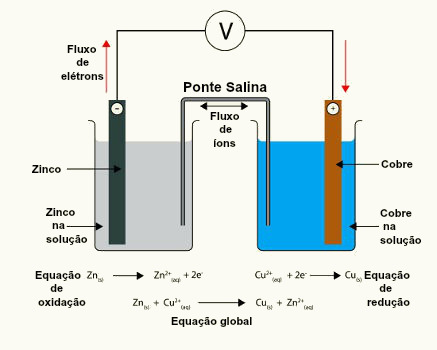
Na primeira pilha (à esquerda), o eletrodo de zinco está agindo como ânion (polo negativo da pilha), pois ele está oxidando e assim doando elétrons para o cobre, que é o cátodo (polo positivo), e que está reduzindo. Isso é mostrado pelas semirreações que ocorrem nessa pilha e por sua reação global, escritas abaixo:
Semirreação do ânodo: Zn (s) → Zn2+(aq) + 2 e-
Semirreação do cátodo: Cu2+(aq) + 2e- →Cu(s)___________
Reação global da pilha: Zn(s) + Cu2+(aq)→ Zn2+ (aq) + Cu(s)
Já no segundo caso, o cobre está funcionando como o ânodo, pois dessa vez é ele quem está doando elétrons para o eletrodo de prata. A prata, portanto, é o cátodo que está recebendo os elétrons:
Semirreação do ânodo: Cu(s) → Cu 2+ (aq) + 2e-
Semirreação do cátodo: 2 Ag + (aq) + 2e- → Ag (s)______
Reação global da pilha: Cu(s) + 2Ag + (aq) → Cu2+(aq) + Ag (s)
Isso nos ajuda a perceber que o zinco é o que tem mais facilidade para oxidar-se em relação ao cobre e à prata. Já a prata é a que tem mais facilidade para se reduzir. Assim, o potencial de redução (Ered)* ou potencial-padrão de redução (E0red) desses três elementos segue a seguinte ordem crescente:
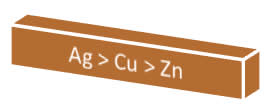
Assim, se quisermos saber se um determinado metal irá oxidar-se ou se seus íons serão reduzidos em uma pilha, é necessário primeiro verificar qual é o outro metal presente nessa pilha.
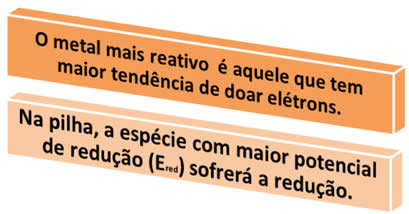
O potencial de redução possui o mesmo valor do potencial de oxidação, porém com sinais opostos. Abaixo listamos uma tabela com os potenciais de redução de alguns metais:
.jpg)
*A IUPAC (União Internacional da Química Pura e Aplicada) aconselha que se trabalhe preferencialmente com potencial-padrão de redução e não o de oxidação.
Aproveite para conferir nossas videoaulas sobre o assunto: