As reações com óxidos duplos, substâncias pertencentes a uma das cinco classes dos óxidos (as outras quatro são os ácidos, básicos, neutros e anfóteros), são realizadas comumente com o objetivo de produzir bases e sais inorgânicos.
Para realizar esses processos químicos, são necessárias as seguintes substâncias como reagentes:
-
Óxido duplo com água;
-
Óxido duplo com ácido inorgânico;
-
Óxido duplo com base inorgânica.
Reações de óxidos duplos com água
Quando um óxido duplo reage com água, ocorre a formação de duas bases inorgânicas, pois esses óxidos apresentam um caráter básico. Cada uma dessas bases é formada pela interação entre cada um dos cátions do metal, que forma o óxido duplo com o ânion hidroxila proveniente da água.
Y3O4 + H2O →Y(OH)a + Y(OH)b
Obs.: Os índices a e b representam a carga do cátion que estava presente no óxido.
Um exemplo é a reação entre o óxido duplo de manganês (Mn3 O4) e a água. Esse óxido é formado pelos cátions Mn+2 e Mn+3. Essa reação resulta nas seguintes interações:
-
Cátion Mn+2 com o ânion OH-1, que forma o Mn(OH)2;
-
Cátion Pb+3 com o ânion OH-1, que forma o Mn(OH)3.
Assim, a equação balanceada que representa a reação é:
1 Mn3O4+ 4 H2O → 1 Mn(OH)2 + 2 Mn(OH)3
Reações de óxidos duplos com ácido
Quando um óxido duplo reage com um ácido qualquer, ocorre a formação de dois sais e água. Os sais são formados pela interação entre cada um dos cátions do metal, que forma o óxido duplo com o ânion do ácido.
Y3O4 + HX →YXa + YXb + H2O
Obs.: Os índices a e b representam a carga do cátion que estava presente no óxido.
Um exemplo é a reação entre o óxido duplo de chumbo (Pb3O4) e o ácido sulfuroso (H2S). Esse óxido é formado pelos cátions Pb+2 e Pb+4. O ácido apresenta o ânion sulfeto (S-2). Essa reação resulta nas seguintes interações:
-
Cátion Pb+2 com o ânion S-2, que forma o PbS;
-
Cátion Pb+4 com o ânion S-2, que forma o Pb2S4 ou PbS2;
-
Cátion hidrônio (H+) do ácido com o óxido O-2, que forma água.
Assim, a equação balanceada que representa a reação é:
1 Pb3O4 + 4 H2S → 2 PbS + 1 PbS2 + 4 H2O
Reações de óxidos duplos com bases
Quando um óxido duplo reage com uma base qualquer, ocorre a formação de dois sais e água. Os sais são formados pela interação entre o cátion da base com cada um dos ânions formados pelo metal do óxido duplo.
Y3O4 + WOH → WYOa + WYOb + H2O
A tabela a seguir indica quais são os ânions formados por cada um dos metais que podem estar presentes em um óxido duplo.
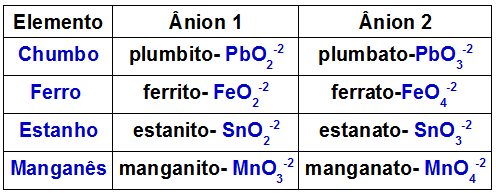
Ânions formados por alguns metais presentes em óxidos duplos
Y3O4 + WOH → WYOa + WYOb + H2O
Um exemplo é a reação entre o óxido duplo de chumbo (Pb3O4) e o hidróxido de potássio (KOH). O chumbo presente no óxido forma os ânions plumbito (PbO2-2) e plumbato (PbO3-2). A base apresenta o cátion K+ e o ânion hidróxido OH-1. Dessa reação, resultam-se as seguintes interações:
-
Cátion K+1 com o ânion PbO2-2, que forma o K2PbO2;
-
Cátion K+1 com o ânion PbO3-2, que forma o K2PbO3.
Assim, a equação balanceada que representa a reação é:
1 Pb3O4 + 6 KOH → 2 K2PbO2 + 1 K2PbO3 + 3 H2O