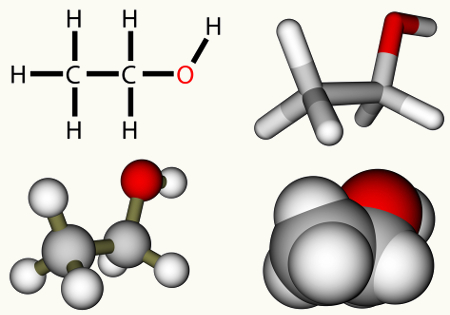
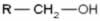As reações de hidratação de alcenos são processos químicos nos quais submetemos esse tipo de hidrocarboneto a um meio que contém água, ácido sulfúrico (H2SO4) e aquecimento (Δ).
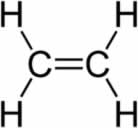
Os alcenos são compostos orgânicos que possuem uma ligação pi, que, na presença de água, ácido sulfúrico e aquecimento, sofre um rompimento (quebra). Quando a ligação pi é rompida, os dois carbonos nos quais ela estava passam a necessitar de uma ligação.
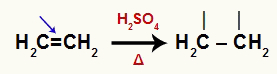
Equação representando o rompimento da ligação pi de um alceno
Cada um dos carbonos realiza uma ligação sigma com os íons provenientes da água. O ácido sulfúrico e o calor promovem o rompimento da ligação entre o hidrogênio e a hidroxila da água, como na equação abaixo:
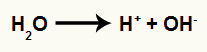
Equação que representa a formação dos íons a partir da água
Veja a representação da ligação de um carbono ao hidrônio e do outro carbono ao hidróxido (íons provenientes da água):
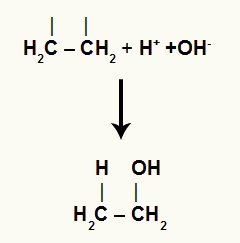
Interação dos íons livres com a estrutura orgânica
→ Regra de Markovnikov na hidratação de alcenos
De acordo com a regra proposta pelo químico russo Markovnikov, em uma reação de hidratação de alcenos, o hidrônio (H+) é adicionado ao carbono mais hidrogenado, e o ânion hidróxido (OH-1) é adicionado ao carbono menos hidrogenado.
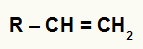
Fórmula estrutural de alceno qualquer
No alceno geral acima, temos o carbono 1 com 2 hidrogênios e o carbono 2 com 1 hidrogênio. Assim, segundo a regra de Markovnikov, o cátion H+ será adicionado ao carbono 1 e o grupo hidróxido (OH-) será adicionado ao carbono 2.
→ Situações da hidratação de alcenos que fogem à regra de Markovnikov
Quando os carbonos da ligação pi possuem a mesma quantidade de hidrogênios, devemos analisar a complexidade ou a quantidade dos ligantes (radicais).
Quanto mais radicais ou quanto maior for o radical ligado ao carbono da ligação dupla, teremos um efeito indutivo positivo que simulará uma grande quantidade de hidrogênios, ou seja, esse carbono receberá o hidrogênio proveniente da água.
Por exemplo:
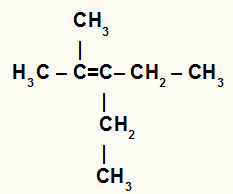
Fórmula estrutural de um alceno ramificado
No alceno acima, temos dois radicais metil ligados ao carbono 2 e, no carbono 3, temos dois radicais etil. Logo, em uma reação de hidratação, o carbono 2 receberia o H+ e o carbono 3 receberia o OH-.
→ Possíveis produtos da hidratação de alcenos
Independentemente do alceno que for utilizado na reação de hidratação, o produto final sempre será um álcool. Porém, nem sempre o mesmo tipo de álcool será formado. Os produtos que podem ser originados em uma reação de hidratação de alcenos são:
-
Álcool primário (possui o grupo OH em um carbono primário)
-
Álcool secundário (possui o grupo OH em um carbono secundário)
-
Álcool terciário (possui o grupo OH em um carbono terciário)
O tipo de álcool formado dependerá do alceno que estiver sofrendo o processo de hidratação. Exemplos:
→ Hidratação do eteno
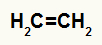
Fórmula estrutural do eteno
Quando o eteno é adicionado a um meio com água, ácido sulfúrico e aquecimento, sua ligação é rompida e os íons hidrônio (H+) e hidróxido (OH-) são formados a partir da água. Como cada um dos carbonos que possuíam a ligação pi necessita de uma nova ligação, um deles recebe o H+, e o outro recebe o OH-.
.jpg)
Equação química que representa a hidratação do eteno
Todos os carbonos do eteno hidratado são primários, logo, essa reação forma um álcool primário.
→ Hidratação do but-2-eno
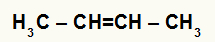
Fórmula estrutural do But-2-eno
Quando o but-2-eno é adicionado a um meio com água, ácido sulfúrico e aquecimento, sua ligação é rompida e os íons hidrônio (H+) e hidróxido (OH-) são formados a partir da água. Como cada um dos carbonos que possuíam a ligação pi necessita de uma nova ligação, um deles recebe o H+, e o outro recebe o OH-.
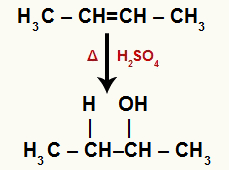
Equação química que representa a hidratação do but-2-eno
Os dois carbonos que realizam a ligação pi apresentam a mesma quantidade de hidrogênios e estão ligados a um grupo metil (CH3). Assim, não importa qual deles receberá o cátion ou o ânion, pois o produto final será o mesmo.
Todos os carbonos do eteno hidratado são secundários, logo, essa reação forma um álcool secundário.
→ Hidratação do 2-metil-pent-2-eno
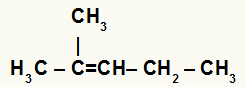
Fórmula estrutural do 2-metil-pent-2-eno
Quando o 2-metil-pent-2-eno é adicionado a um meio com água, ácido sulfúrico e aquecimento, sua ligação é rompida e os íons hidrônio (H+) e hidróxido (OH-) são formados a partir da água.
Nesse alceno, o carbono 2 não possui nenhum hidrogênio e o carbono 3 apresenta um. Logo, em uma reação de hidratação, o carbono 2 recebe o OH- e o carbono 3 recebe o H+.
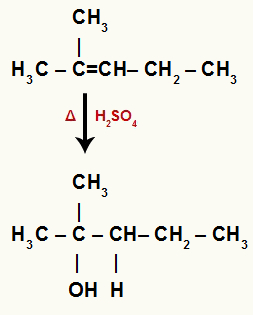
Equação química que representa a hidratação do 2-metil-pent-2-eno
Como o OH foi adicionado a um carbono terciário, logo, temos um álcool terciário.