Reações de Ustulação são processos químicos nos quais sulfetos inorgânicos são submetidos a uma combustão na presença de um ar muito quente e no interior de fornos especiais. O objetivo desse processo é a produção de óxidos metálicos ou metais nobres puros.
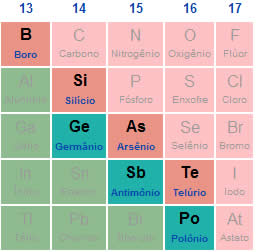
Para compreender uma reação de ustulação, é importante saber o que é um sulfeto. Sulfetos são substâncias inorgânicas binárias (formadas por apenas dois elementos químicos) em que, obrigatoriamente, um de seus elementos é o enxofre (sempre com NOX -2) e o outro é um metal. A fórmula geral de um sulfeto é:
YS
O metal que compõe o sulfeto pode ser de natureza nobre ou não nobre:
-
Metal nobre: trata-se de um metal de baixíssima eletropositividade (capacidade de perder elétrons em uma ligação química com outro elemento). Por essa razão, apresenta uma grande dificuldade de interagir (realizar ligações químicas) com outros átomos. Os átomos de metais considerados nobres são:
→ Prata (Ag+1)
→ Ouro (Au+1)
→ Cobre II (Cu+2)
→ Mercúrio (Hg2+2)
→ Mercúrio (Hg+2)
→ Platina II (Pt+2)
→ Paládio (Pd+2)
-
Metal não nobre: trata-se de um metal de alta eletropositividade, sendo, por isso, bastante reativo (capaz de interagir com outros átomos).
Como o metal que compõe o sulfeto pode apresentar uma natureza diferente, o produto formado durante uma reação de ustulação também pode ser diferente. Dessa forma, via de regra, temos:
-
Sulfeto com metal nobre: Ustulação forma metal puro e dióxido de enxofre;
-
Sulfeto com metal não nobre: Ustulação forma óxido e dióxido de enxofre.
Equações de reações de Ustulação:
-
Se sulfeto com metal nobre:
YS + O2 → Y + SO2
-
Se sulfeto com metal não nobre:
YS + O2 → YO + SO2
Exemplos de reações de Ustulação:
Exemplo 1: Reação entre o sulfeto de zinco e oxigênio
ZnS(s) + O2(g) →?
O zinco presente no sulfeto não é um metal nobre, por isso, na combustão, vamos ter a formação de um óxido e do gás dióxido de enxofre. No óxido, como o oxigênio apresenta NOX -2 (O-2) e o Zinco apresenta NOX +2 (Zn+2), ao cruzar as cargas, teremos a fórmula resultante ZnO.
ZnS(s) + O2(g) → ZnO(s) + SO2(g)
Como o número de átomos de oxigênio não é igual no reagente e produto, a equação não está balanceada. Para balanceá-la, basta utilizar o coeficiente 3/2 no gás oxigênio do reagente:
ZnS(s) + 3/2 O2(g) → ZnO(s) + SO2(g)
Exemplo 2: Reação entre o Sulfeto de Alumínio e Oxigênio
Al2S3(s) + O2(g) →?
O alumínio presente no sulfeto não é um metal nobre, por isso, na combustão, vamos ter a formação de um óxido e do gás dióxido de enxofre. No óxido, como o oxigênio apresenta NOX -2 (O-2) e o alumínio apresenta NOX +3 (Al+3), ao cruzar as cargas, teremos a fórmula resultante Al2O3.
Al2S3(s) + O2(g) → Al2O3(s) + SO2(g)
Como o número de átomos de enxofre e o de oxigênio não são iguais nos reagentes e produtos, a equação não está balanceada. Para balanceá-la, basta utilizar o coeficiente 3 no Dióxido de Enxofre formado e 9/2 no gás Oxigênio do reagente:
Al2S3(s) + 9/2O2(g) → Al2O3(s) + 3 SO2(g)
Exemplo 3: Reação entre o Sulfeto de prata e Oxigênio
Ag2S(s) + O2(g) →?
A Prata presente no sulfeto é um metal nobre, por isso, na combustão, vamos ter a formação do metal Prata (Ag) e do gás Dióxido de Enxofre:
Ag2S(s) + O2(g) → Ag(s) + SO2(g)
Como o número de átomos de Prata não é igual no reagente e produto, a equação não está balanceada. Para balanceá-la, basta utilizar o coeficiente 2 na Prata formada:
Ag2S(s) + O2(g) → 2 Ag(s) + SO2(g)
Exemplo 4: Reação entre o Sulfeto de Platina II e Oxigênio
PtS(s) + O2(g) →?
A Platina II presente no Sulfeto é um metal nobre, por isso, na combustão, vamos ter a formação do metal platina (Pt) e do gás dióxido de enxofre:
PtS(s) + O2(g) → Pt(s) + SO2(g)
Como o número de átomos de Platina, Enxofre e Oxigênio são iguais nos reagentes e produtos, a equação já está balanceada.