Sais são substâncias de caráter iônico formadas pela ligação de um metal com um ametal. O seu representante mais conhecido é o cloreto de sódio (NaCl). A fórmula química de um sal pode ser representada de forma genérica por:
XY
X é um cátion originado a partir de um metal e Y é um ânion qualquer (simples ou composto).
Neste texto vamos dar ênfase na solubilidade dos sais, que, muitas vezes, é atribuída a eles de forma errada. Como o cloreto de sódio é utilizado diariamente, as pessoas pensam que todo sal se dissolve em água como ele, mas não é bem assim.
Em relação à solubilidade, os sais podem ser:
-
Solúveis (aqueles que apresentam boa solubilidade em água);
-
Praticamente insolúveis (aquele que apresentam baixíssima solubilidade em água).
Para identificar se um sal é solúvel ou praticamente insolúvel, é interessante conhecer a tabela referente à solubilidade dos sais. Nela temos a relação entre os possíveis cátions e ânions que formam um sal.
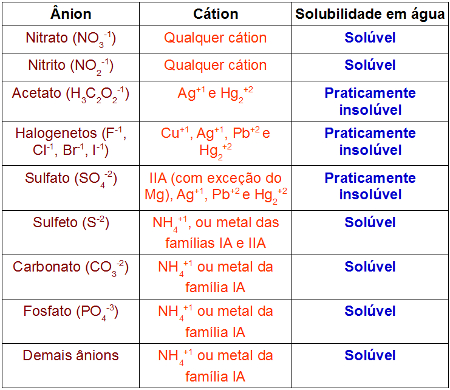
Tabela de solubilidade para sais relacionando ânion e cátion
Veja alguns exemplos de classificação de sais em relação à solubilidade.
Exemplo 1: Fosfato de chumbo II [Pb3(PO4)2]
Sal praticamente insolúvel
O sal recebe essa classificação quanto à solubilidade porque o elemento Chumbo (Pb) pertence à família IVA e o ânion fosfato (PO4-3) só forma sal solúvel quando apresenta o cátion amônio (NH4+) ou elemento da família IA.
Exemplo 2: Carbonato de sódio (Na2CO3)
Sal solúvel
O sal recebe essa classificação quanto à solubilidade porque o elemento Sódio (Na) pertence à família IA e o ânion carbonato (CO3-2) só forma sal solúvel quando apresenta o cátion amônio (NH4+) ou elemento da família IA.
Exemplo 3: Sulfato de cálcio (CaSO4)
Sal praticamente insolúvel
O sal recebe essa classificação quanto à solubilidade porque o metal presente nele é o Cálcio (Ag). Além disso, o ânion sulfato (SO4-2) forma sal praticamente insolúvel sempre que está acompanhado de um dos seguintes cátions: Ag+1, Pb+2, Hg2+2, Cu+1 e os da família IIA (menos o elemento Magnésio).
Exemplo 4: Nitrato de ferro III [Fe(NO3)3]
Sal solúvel
O sal recebe essa classificação quanto à solubilidade porque o ânion nitrato (NO31) só forma sal solúvel, independentemente do cátion do qual ele estiver acompanhado.
Exemplo 5: Cloreto de prata (AgCl)
Sal praticamente insolúvel
O sal recebe essa classificação quanto à solubilidade porque o metal presente nele é a Prata (Ag) e o ânion cloreto (Cl-1) forma sal praticamente insolúvel sempre que está acompanhado de um dos seguintes cátions: Ag+1, Pb+2, Hg2+2 e Cu+1.
Exemplo 6: Acetato de magnésio [Mg(H3C2 O2 )2].
Sal praticamente solúvel
O sal recebe essa classificação quanto à solubilidade porque o metal presente nele é o Magnésio (Mg) e o ânion acetato (H3C2 O2 -1) forma sal praticamente insolúvel sempre que está acompanhado de um dos seguintes cátions: Ag+1 e Hg2+2.
Videoaula relacionada: