Um tema de química muito recorrente no Enem é Termoquímica. Para facilitar e enriquecer o seu estudo, elaboramos dicas sobre cálculos que envolvem essa área de estudo. Vamos lá?
1ª Dica: Unidades de medida utilizadas na Termoquímica
A Termoquímica é um ramo da Físico-química que estuda a quantidade de energia (na forma de calor) liberada ou absorvida em uma reação química. As unidades utilizadas para as medidas de calor são:
-
calorias (cal) ou quilocalorias (Kcal), sendo 1 Kcal = 1000 cal;
-
Joules (J) ou quilojoules (KJ), sendo 1KJ = 1000 KJ.
*1 cal = 4,18 J
2ª Dica: Fórmulas utilizadas em Termoquímica
a) Para calcular a variação da entalpia de uma reação:
ΔH = Hp – Hr
-
ΔH: variação da entalpia
-
Hp: entalpia dos produtos
-
Hr: entalpia dos reagentes
Essa fórmula é utilizada quando o exercício fornece os valores das entalpias dos participantes (reagentes e produtos) da reação. Por exemplo:
Sabendo que as entalpias de formação das moléculas X2, Y2 e XY são, respectivamente, -68,3 Kcal, -40 Kcal e -92,37 Kcal, determine o valor do ΔH dessa reação química.
1X2 + 1Y2 → 2XY
1o Passo: Determinar a entalpia nos reagentes. Para isso, somamos os resultados da multiplicação do coeficiente estequiométrico do reagente pela sua entalpia:
Hr = 1.(-68,3) + 1.(-40)
Hr = - 68,3 -40
Hr = - 108,3 Kcal Kcal
2o Passo: Determinar a entalpia nos produtos. Para isso, somamos os resultados da multiplicação do coeficiente estequiométrico do produto pela sua entalpia:
Hp = 2.(-92,37)
Hp = - 184,74 Kcal
3o Passo: Calcular a variação da entalpia com a seguinte fórmula:
ΔH = Hp - Hr
ΔH = - 184,74 + (- 108,3)
ΔH = - 184,74 - 108,3
ΔH = - 293,04 Kcal
b) Para calcular a variação da entalpia em uma questão sobre lei de Hess:
ΔH = ΔH1 + ΔH2 + ΔH3 + ...
ΔH1: variação da entalpia da 1a reação
ΔH2: variação da entalpia da 2a reação
ΔH3: variação da entalpia da 3a reação
Essa fórmula é utilizada quando a questão fornece a variação da entalpia de cada uma das reações envolvidas no processo químico.
Exemplo: Dadas as equações e seus respectivos valores de entalpias:
1Cgrafita + 1 O2 → 1 CO2 ΔH = -94,1 Kcal/mol
1 CO2 → 1 Cdiamante + 1 O2 ΔH = -94,1 Kcal/mol ΔH = 94,5 Kcal/mol
Determine a variação da entalpia do processo abaixo:
1Cgrafita → 1 Cdiamante
Para determinar o valor da entalpia da equação acima, basta somamos os valores das variações de entalpia fornecidos:
ΔH = ΔH1 + ΔH2
ΔH = -94,1 + 94,5
ΔH = 0,4 Kcal
OBS.: Foi realizada a soma direta dos valores dos ΔH fornecidos porque os itens (O2 e CO2) que se repetem nas equações não aparecem na equação final e estão em lados opostos da seta.
c) Para calcular a variação da entalpia em um exercício sobre energia de ligação:
ΔH = Hr + Hp
Essa fórmula é utilizada quando a questão fornece os valores das energias de ligação de cada um dos átomos envolvidos no processo químico.
OBS.: As energias de ligação nos reagentes sempre são trabalhadas com valores positivos, enquanto as dos produtos apresentam valores negativos.
Exemplo: Sabendo que as energias de ligação nas moléculas H2, F2 e HF são, respectivamente, -104,2 Kcal, -36,6 Kcal e -134,6 Kcal, determine o valor do ΔH dessa reação química.
1H2 + 1F2 → 2HF
1o Passo: Determinar a energia das ligações presentes nos reagentes. Para isso, somamos os resultados da multiplicação do número de vezes que a ligação aparece na fórmula das substâncias dos reagentes. Nunca esqueça que o coeficiente estequiométrico da equação deve multiplicar sempre o valor da energia da ligação.
Hr = 1.1.(104,2) + 1.1.(36,6)
Hr = 104, 2 + 36,6
Hr = 140,8 Kcal
2o Passo: Determinar a energia das ligações presentes nos produtos. Para isso, somamos os resultados da multiplicação do número de vezes que a ligação aparece na fórmula das substâncias do produto:
Hp = 1.2.(-134,6)
Hp = 2. (-134,6)
Hp = - 269,2 Kcal
3o Passo: Calcular a variação da entalpia na fórmula referente à energia de ligação:
ΔH = Hr + Hp
ΔH = 140,8 + (- 269,2)
ΔH = 140,8 - 269,2
ΔH = - 128,4 Kcal
d) Para calcular a variação da entropia de uma reação
ΔS = Sp – Sr
-
ΔS: variação da entalpia
-
Sp: entropia dos produtos
-
Sr: entalpia dos reagentes
Essa fórmula é utilizada quando a questão fornece os valores das entropias dos participantes (reagentes e produtos) da reação.
Exemplo: Sabendo que as entalpias de formação das moléculas H2, Cl2 e HCl são, respectivamente, 130,67 Kcal, 223,09 Kcal e 186,8 Kcal, determine o valor do ΔH dessa reação química.
1H2 + 1Cl2 → 2 HY
1o Passo: Determinar a entropia nos reagentes somando os resultados da multiplicação do coeficiente estequiométrico do reagente pela sua entalpia:
Hr = 1.(130,67) + 1.(223,09)
Hr = - 68,3 -40
Hr = 353,76Kcal Kcal
2o Passo: Determinar a entropia no produto somando os resultados da multiplicação do coeficiente estequiométrico do produto pela sua entalpia:
Hp = 2.(186,8)
Hp = 373.6 Kcal
3o Passo: Calcular a variação da entalpia com a seguinte fórmula:
ΔH = Hp - Hr
ΔH = - 184,74 + (- 108,3)
ΔH = - 184,74 - 108,3
ΔH = - 293,04 Kcal
e) Para calcular a variação da energia livre de Gibbs
ΔG = ΔH – ΔS.T
-
ΔG: variação da energia livre de Gibbs
-
T: temperatura da reação
Essa fórmula é utilizada quando a questão fornece os valores da variação da entropia, variação da entalpia e a temperatura.
Exemplo: Determine a variação da energia livre de Gibbss do processo químico representado abaixo. Saiba que ela foi realizada a 25 oC e que os valores das variações de entalpia e entropia são, respectivamente, -19 Kcal/mol e 18 cal/mol.
1o Passo: transformar o valor da entalpia de cal para Kcal. Para isso, basta dividirmos por 1000:
ΔH = 100. 18
ΔH = 1800 Kcal/0mol
2o Passo: Transformar a temperatura fornecida em Celsius para Kelvin. Para isso, bastar somar o valor com 273:
T = 25 + 273
T = 298 K
3o Passo: Calcular o ΔH
ΔG = ΔH – ΔS.T
ΔG = 1800– 18.298
ΔG = 3564
3ª Dica: Interpretação de resultado de cálculos na Termoquímica
-
Para ΔH > 0, reação é endotérmica;
-
Para ΔH< 0, reação é exotérmica;
-
Para ΔS > 0, reação tende a não ser espontânea;
-
Para ΔS < 0, reação tende a ser espontânea;
-
Para ΔG > 0, reação não é espontânea;
-
Para ΔG < 0, reação é espontânea.
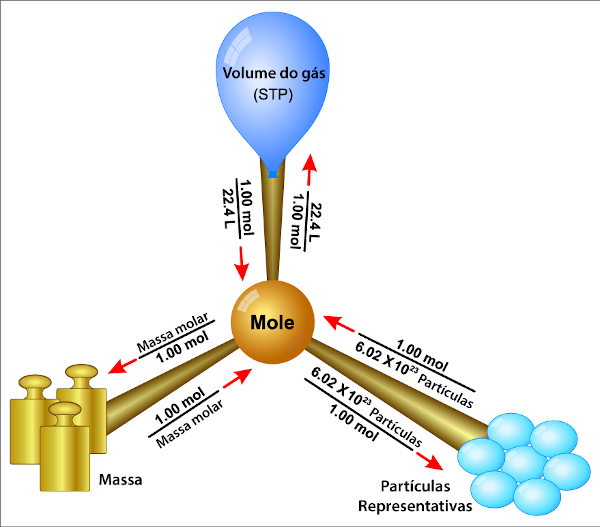
4ª Dica: Relação entre massa molar e variação de entalpia
Muitas questões sobre Termoquímica relacionam a quantidade de energia absorvida ou liberada na reação com a massa molar de alguma substância presente no processo.
Quando isso ocorre, a questão fornece a quantidade de energia (liberada ou absorvida) em cal ou Kcal/mol ou em J ou KJ/mol, bem como a massa utilizada de uma substância qualquer.
Exemplo: Determine a quantidade de calor liberada na queima de 10 gramas de uma vela (C20H42). Saiba que se trata de uma reação cujo ΔH é igual a – 13300 KJ/mol.
1o Passo: Calcular a massa molar (M1, em g/mol) da vela. Para isso, multiplicamos a quantidade de átomos do elemento pela sua massa molar e, depois, somamos os resultados:
M1 = 20.12 + 42.1
M1 = 240 + 42
M1 = 282 g/mol
2o Passo: Montar uma regra de três. Na primeira linha, utilizamos a energia fornecida (13300 KJ/mol) e a massa calculada (282 g/mol); na segunda linha, utilizamos a massa fornecida (10 gramas):
282 gramas …......... - 13300KJ
10 gramas …......... x
282.x = 10. (- 13300)
282.x = - 133000
x = - 133000
282
x = - 471,63 KJ/mol
Aproveite para conferir nossa videoaula sobre o assunto: