O primeiro cientista a realizar experimentos envolvendo a relação entre o volume e a temperatura dos gases foi o físico francês Jacques Alexandre César Charles (1746-1823). Porém, quem passou a quantificar essa relação foi o químico francês Joseph Louis Gay-Lussac (1778-1850).
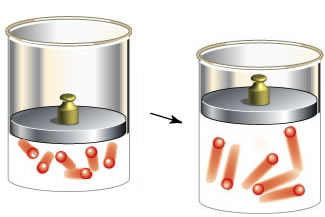
Ambos chegaram à mesma conclusão: o volume e a temperatura dos gases são diretamente proporcionais. Isso pode ser visualizado e entendido por meio de uma experiência simples: ao colocarmos uma garrafa, com um balão em seu gargalo, em uma panela contendo água quente, veremos que o balão encherá. Isso significa que, com o aumento da temperatura, houve aumento do volume ocupado pelas moléculas do gás. No entanto, se colocarmos a garrafa com o balão em uma panela com água fria, veremos o balão murchar. O ar, que é o gás analisado, se contrai e ocupa um volume menor com a diminuição da temperatura.

Atenção: é interessante lembrar queo volume aumenta, mas a quantidade de partículas do gás é a mesma. O que ocorre é que, com o aumento da temperatura, aumenta-se também a energia cinética das partículas que irão se movimentar com maior velocidade, expandindo-se e aumentando o volume. O contrário também é verdadeiro:com a diminuição da temperatura, a energia cinética das partículas diminui e elas se movimentam mais devagar, contraindo-se e, consequentemente, diminuindo o volume.
Por meio de experimentos mais exatos, pode-se determinar exatamente qual é essa proporcionalidade entre a temperatura e o volume do gás à pressão constante. Criou-se, assim, a primeira Lei de Charles e Gay-Lussac, que diz:

Em termos matemáticos, temos:

Onde:
V = volume ocupado pelo gás;
T = Temperatura termodinâmica do gás;
k = constante de proporcionalidade do gás.
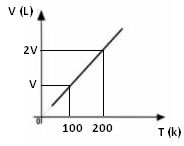
Pela expressão matemática acima, vemos que o volume e a temperatura variam na mesma proporção direta. Ou seja, se dobrarmos a temperatura, o volume também dobra; se diminuirmos pela metade a temperatura, o volume também cairá pela metade; e assim sucessivamente. Portanto, a divisão dessas duas grandezas dá uma constante entre elas, que é simbolizada pela letra k.
Seja qual for a variação sofrida pelo volume e pela temperatura, a constante será sempre o mesmo valor, assim, podemos dizer que:
V1=V2 ou Vinicial =Vfinal
T1 T2 Tinicial Tfinal
Isso significa que é possível descobrir qual será o volume quando alterarmos o valor da temperatura; desde que saibamos os valores do volume e da temperatura iniciais e qual foi a alteração na temperatura. O mesmo pode ser conseguido para a temperatura final se soubermos qual é o volume final.
O gráfico da variação do volume em relação à temperatura, com pressão e massa fixa, para um gás, é sempre uma reta, conforme pode ser visto abaixo: