No estudo dos gases, é preciso relacionar suas três variáveis, que são: a pressão (P), o volume (V) e a temperatura (T).
Ao longo da história, esses estudos foram feitos relacionando essas variáveis, porém sempre mantendo uma delas constante. Por exemplo, ao se estudar a relação das variações da pressão de um gás com as variações de sua temperatura, o volume permaneceu constante e assim por diante.
Vários cientistas realizaram experimentos para entender o comportamento dos gases, porém três deles se destacaram: o físico e químico irlandês Robert Boyle (1627-1691) e os cientistas franceses Joseph Louis Gay-Lussac (1778-1850) e Jacques Alexandre César Charles (1746-1823).
Esses cientistas formularam leis a respeito do comportamento dos gases ao sofrerem transformações gasosas, são elas:
• Transformação isotérmica e Lei de Boyle;
• Transformação isobárica e Lei de Gay-Lussac;
• Transformação isocórica ou isovolumétrica e Lei de Charles/Gay-Lussac.
Vejamos do que se trata cada uma delas:
Transformação isotérmica e Lei de Boyle (T=constante)
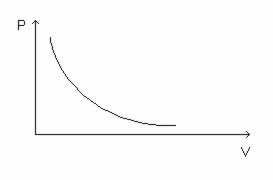
Nesse caso, um gás com massa fixa e temperatura constante tem o volume e a pressão variados. Segundo a Lei de Boyle: o volume ocupado por determinado gás com a temperatura constante é inversamente proporcional à sua pressão.
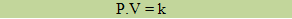
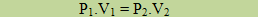
Onde P1 e V1 são as variáveis iniciais e P2 e V2 são as variáveis finais.
Sua representação gráfica é sempre uma hipérbole, chamada de isoterma:
Transformação isobárica e Lei de Gay-Lussac ou Lei de Charles Gay-Lussac* (P=constante)
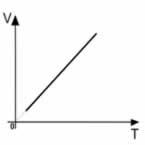
Um gás com massa fixa, permanecendo com a pressão constante, tem o volume e a temperatura variados. Segundo a Lei de Gay-Lussac: o volume ocupado por determinado gás com a pressão constante é diretamente proporcional à sua temperatura.
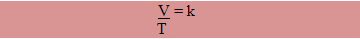
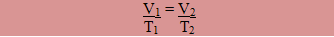
Onde T1 e V1 são as variáveis iniciais e T2 e V2 são as variáveis finais.
Sua representação gráfica é sempre uma reta:
Transformação isocórica ou isovolumétrica e Lei de Charles ou Lei de Charles Gay-Lussac* (V=constante)
Um gás com massa e volume fixos sofre variação na sua pressão e na sua temperatura. Segundo a Lei de Charles: a pressão ocupada por determinado gás com o volume constante é diretamente proporcional à sua temperatura.
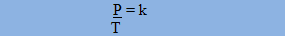
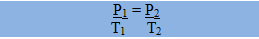
Onde T1 e P1 são as variáveis iniciais e T2 e P2 são as variáveis finais. Sua representação gráfica também é sempre uma reta:
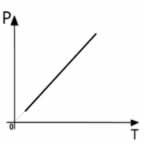
* As duas últimas leis foram estudadas por Gay-Lussac e por Charles, assim, em alguns livros os nomes dessas leis diferem; em alguns aparece Lei de Gay-Lussac, ou Lei de Charles ou ainda Lei de Gay-Lussac/Charles.