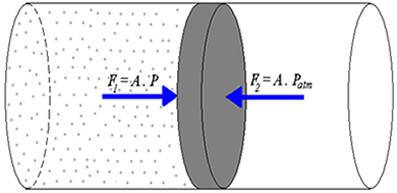
Vamos considerar a figura acima, na qual temos um cilindro fechado em uma extremidade, contendo uma porção de gás em seu interior, e um êmbolo que pode se movimentar sem atrito deixando o gás isolado do meio externo.
O êmbolo está sujeito a duas forças em razão das pressões interna (do gás) e externa (da atmosfera). Na situação de equilíbrio, o êmbolo está parado: essas forças são iguais e com sentidos opostos. Como as áreas das duas faces do êmbolo são iguais, as pressões interna e externa também deverão ser iguais.
Se aquecermos o gás desse cilindro, mantendo a pressão constante, sua temperatura aumentará e o êmbolo se deslocará aumentando o volume ocupado pelo gás, pois PV = nRT. Vamos chamar de Δx o deslocamento sofrido pelo êmbolo. Veja a figura abaixo.
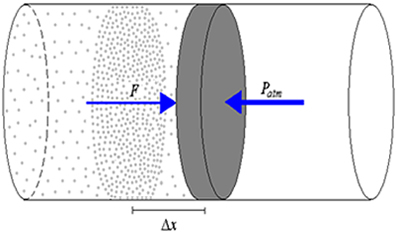
Podemos calcular o trabalho (τ) realizado pela força interna usando a expressão:
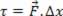
A força e o deslocamento, que são grandezas vetoriais, têm a mesma direção e o mesmo sentido e, portanto, podemos usar os seus módulos para calcular o trabalho:
τ=F.∆x
Mas como:

Onde A é a área do êmbolo, P é a pressão do gás e F a força que atua no êmbolo. Então,
τ=P.A.∆x
O produto A.Δx é a variação de volume sofrida pelo gás:
∆V=Vfinal-Vinicial=A.∆x
Substituindo na expressão para o trabalho, obtemos:
τ=P.∆V=V(Vfinal-Vinicial)
Essa expressão relaciona o trabalho realizado pelo gás. O valor do trabalho calculado poderá ser positivo ou negativo, de acordo com a variação do volume ΔV. O sistema realiza trabalho quando seu volume aumenta. Nesse caso, ΔV é positivo e o trabalho também. Se o volume do sistema diminui, significa que forças externas atuaram sobre ele. Nesse caso, o trabalho foi realizado sobre o sistema. Então, a variação de volume e o trabalho são negativos.