Alotropia é o fenômeno em que um mesmo elemento químico forma substâncias simples diferentes. Os átomos de Carbono sofrem alotropia, eles podem se unir de várias formas diferentes formando inúmeras substâncias, é o que chamamos de Alotropia por arranjo geométrico.
O diamante, o grafite e o fulereno são alótropos do carbono e se diferem pela forma que os átomos são unidos (arranjo molecular). Essas três formas são substâncias simples formadas apenas por carbono.
Propriedades dos alótropos do carbono:
O diamante é um isolante elétrico e térmico, transparente e duro. Essa última característica permite que seja utilizado para cortar blocos de granito. Sua densidade é 3,51g/cm3.
O grafite constitui um sólido macio e cinza, é um bom condutor de calor e eletricidade, e possui densidade = 2,25 g/cm3.
O fulereno é uma forma alotrópica produzida artificialmente, possui forma tridimensional composta apenas por ligações insaturadas. Esse composto orgânico apresenta propriedades que são exploradas em várias áreas da bioquímica e da medicina, na composição de medicamentos.
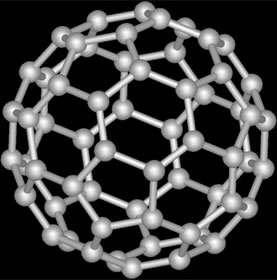
Observe a diferença no rearranjo molecular dos alótropos do carbono:
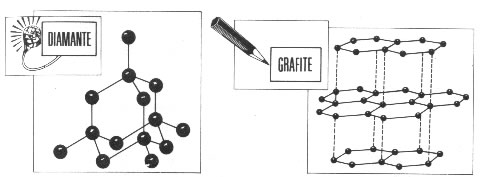
Repare que as duas formas (diamante e grafite) são compostas pelo mesmo elemento (carbono), mas que, em razão do rearranjo dos átomos, se transformam em substâncias com propriedades completamente diferentes. O diamante possui dureza elevada e pode ser usado, como já foi dito, para cortar superfícies duras, já o grafite é frágil e quebradiço. O lápis tem a ponta de grafite facilmente quebrada quando exercemos força sobre ela.
Aproveite para conferir a nossa videoaula relacionada ao assunto: