As propriedades periódicas dos elementos químicos são aquelas que apresentam valores que crescem ou decrescem em intervalos de números atômicos periódicos, ou seja, repetitivos. Alguns exemplos são o raio atômico, a energia de ionização, a eletronegatividade, a eletroafinidade e a eletropositividade. Neste texto iremos falar sobre esta última propriedade citada.

Essa propriedade também é chamada de caráter metálico, porque os metais possuem uma grande tendência de perder elétrons em ligações iônicas e de se afastar de seus elétrons mais externos quando ligados com elementos de alta eletronegatividade, formando ligações covalentes.
A eletronegatividade é exatamente o oposto da eletropositividade, isto é, corresponde à tendência que o elemento possui de atrair os elétrons compartilhados em uma ligação química.
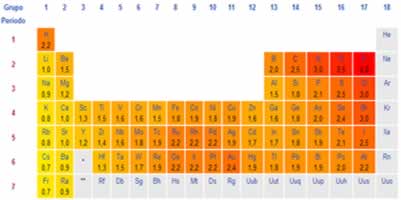
Assim, a eletropositividade é uma propriedade periódica que aumenta no decorrer da tabela periódica ao contrário da eletronegatividade. Como dito no texto Eletronegatividade, essa propriedade cresce de baixo para cima e da esquerda para a direita na Tabela. Portanto, a eletropositividade na tabela periódica aumenta de cima para baixo e da direita para a esquerda.

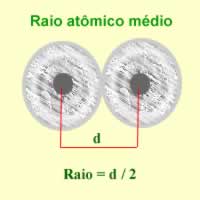
Quando consideramos os elementos pertencentes a uma mesma família na Tabela Periódica (em uma mesma coluna), vemos que a eletropositividade aumenta de cima para baixo, que é o mesmo sentido do aumento do raio atômico. Isso acontece porque é nesse sentido que o raio atômico vai aumentando, ou seja, vai aumentando as quantidades de camadas eletrônicas do átomo e, consequentemente, os elétrons da camada mais externa vão ficando cada vez mais afastados do núcleo, diminuindo a atração entre eles e aumentando a tendência do átomo de perder elétrons.
Agora, quando consideramos os elementos pertencentes a um mesmo período (linhas), vemos que o raio atômico aumenta da direita para a esquerda, porque o número de camadas eletrônicas em determinado período é o mesmo para os elementos de todas as famílias, porém, conforme vai aumentando a família, maior é o número de elétrons. Com mais elétrons, maior será a atração deles pelo núcleo e o raio diminui. É por isso que a eletropositividade cresce no mesmo sentido que o do raio atômico na Tabela Periódica, isto é, da direita para a esquerda.
Videoaulas relacionadas: