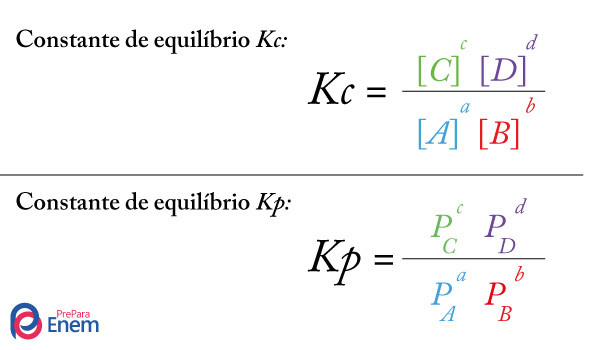A água possui vários papéis importantes em nosso cotidiano, dentre eles está sua participação química em soluções. Por exemplo, a água é capaz de se autoionizar, conforme mostrado na equação química a seguir, por isso qualquer solução aquosa apresenta os íons hidrônio (H3O+(aq)) e hidróxido (OH-(aq)).
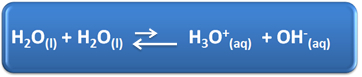
Nesse processo de autoionização, uma molécula de água age como ácido, doando um próton (H+); e outra molécula age como base, recebendo o próton. Isso significa que a água conduz corrente elétrica, pois ela possui íons.
Calculando-se o produto iônico da água (Kw) ousua constante de ionização, temos a expressão abaixo, já que líquidos não participam dessa expressão de equilíbrio:

No entanto, o grau de ionização da água e seu produto iônico são muito baixos. Para se ter uma ideia, à temperatura de 25 ºC, as concentrações do íon H3O+(aq) e OH-(aq) são iguais a 1 . 10-7 mol/L. Esse é um valor muito pequeno, o que indica que o equilíbrio encontra-se muito deslocado para o sentido inverso (à direita), para a formação das moléculas de água e consumo dos íons. Isso explica a baixa condutividade elétrica da água.
Calculando o produto iônico da água para a temperatura de 25 ºC, temos:
Kw = [H3O+] . [OH-]
Kw = (1 . 10-7) . (1 . 10-7)
Kw = 10-14
Visto que o produto iônico é uma constante, ela só sofre alteração se mudarmos a temperatura. Além disso, mesmo que o meio não esteja neutro e existam mais íons H3O+do que OH-, ou vice-versa, o produto iônico, isto é, a multiplicação da concentração desses íons, sempre dará o mesmo valor em determinada temperatura.
Veja a seguir alguns exemplos de variações das concentrações desses íons e do produto iônico da água em diferentes temperaturas:

Esses dados mostram que à medida que se aumenta a temperatura, as concentrações dos íons hidrônio e hidróxido e o produto iônico da água serão maiores.