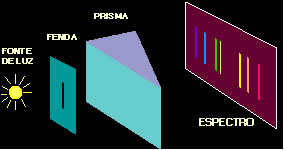
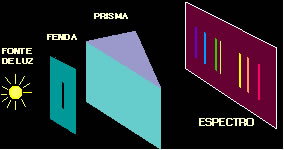
Espectro é o conjunto de cores obtido através da dispersão dos componentes de uma luz; ele pode ser contínuo ou descontínuo.
No início do século XVII, o famoso cientista Isaac Newton fez a luz solar (luz branca) passar por um prisma, e foi decomposta nas sete cores do arco-íris, obtendo um espectro contínuo, ou seja, a passagem de uma cor para a outra é praticamente imperceptível.
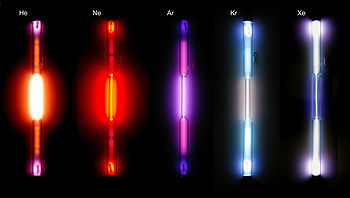
Em meados de 1855, Bunsen (criador do Bico de Bunsen) percebeu que cada composto emitia uma determinada cor ao ser submetido à ação de uma chama. Quando essa luz passava por um prisma, produzia-se um espectro diferente do espectro solar. As linhas ou raias de cada cor eram espaçadas, claras e finas. Sendo, portanto, espectros descontínuos.
Algum tempo depois, o físico alemão Joseph von Fraunhofer trabalhava com materiais ópticos e construiu um aparelho capaz de identificar exatamente o tipo de luz emitida ou absorvida por determinado elemento ou substância. Este aparelho ficou denominado espectroscópio.
Conforme mostra a figura abaixo, no espectroscópio contém a fonte de luz, normalmente vinda de um tubo de descarga de gás. Essa luz emitida passa por uma fenda estreita para ser focada por uma lente e passar pelo prisma. No espectroscópio contém também uma chapa fotográfica onde, depois que a luz foi refratada (desviada) pelo prisma, é então registrado o espectro.
Desse modo, podia-se usar cada um destes espectros como uma espécie de “digital” de cada elemento químico; pois cada um produzia um espectro característico. Alguns exemplos de espectros, contínuo e descontínuos, estão representados a seguir.
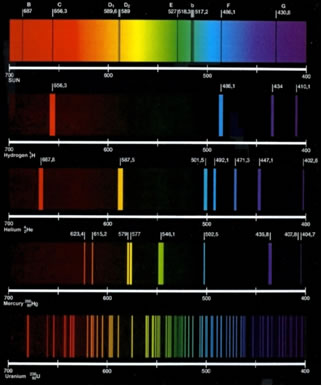
Espectros (de cima para baixo): 1 – solar (contínuo), 2 - hidrogênio, 3 - Hélio,
4 - Mercúrio e 5 -Urânio (descontínuos).
Videoaula relacionada: