No texto “Regra do octeto nas ligações químicas” você viu que a maioria das substâncias é formada por ligações químicas que se realizam porque os elementos representativos possuem a tendência de adquirir a configuração eletrônica de gás nobre para se tornarem estáveis. Isso significa que eles precisam ter 2 elétrons na camada mais externa se essa for a única camada, ou 8 elétrons na camada mais externa se o átomo possuir duas camadas eletrônicas ou mais.
No entanto, como toda regra que se preze, a regra do octeto possui suas exceções. Essas exceções podem se dar de três formas principais:
- Estabilidade com menos de 8 elétrons;
- Estabilidade com mais de 8 elétrons;
- Moléculas com número ímpar de elétrons.
Veja cada caso:
- Estabilidade com menos de 8 elétrons:
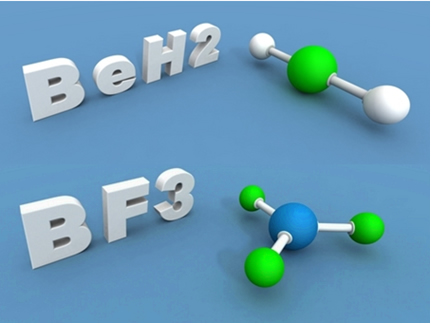
Isso acontece com o berílio (Be) e com o boro (B). Por exemplo, na molécula abaixo o berílio realiza duas ligações covalentes com o hidrogênio, mas ele fica com apenas 4 elétrons na camada de valência:

Já no caso do boro no composto a seguir, ele fica estável com 6 elétrons:
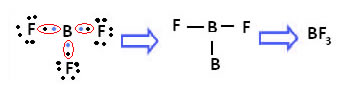
Nesses casos dizemos que houve uma contração do octeto.
- Estabilidade com mais de 8 elétrons:
Essa expansão do octeto ocorre exclusivamente com elementos do terceiro período, principalmente o enxofre (S) e o fósforo (P), porque esses átomos são relativamente grandes para acomodar tantos elétrons ao seu redor. Um exemplo é o sulfato de hidrogênio (que em solução aquosa forma o ácido sulfúrico):
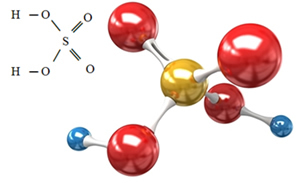
Observe que o enxofre compartilha seus elétrons com quatro átomos de oxigênio, ficando com um total de 12 elétrons na camada de valência.
Outro caso especial de expansão do octeto ocorre com os gases nobres. Apesar de serem encontrados isolados de forma estável na natureza, é possível produzir compostos dos gases nobres, como o seguinte exemplo:
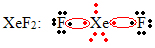
Aqui o xenônio possui 10 elétrons ao seu redor.
Isso também só acontece com os gases nobres grandes, que comportam a camada expandida de valência.
- Moléculas com número ímpar de elétrons:
Se a quantidade de elétrons na camada de valência der um número ímpar, significa que tal elemento não segue a regra do octeto. Há poucos compostos que completam dessa forma a sua camada de valência, um exemplo é o dióxido de nitrogênio (NO2):
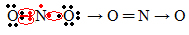
Nesse caso o nitrogênio ficou com 7 elétrons em sua camada de valência.
Diante de tantas exceções, como saber se uma molécula segue ou não a regra do octeto?Para isso basta calcular a carga formal dos átomos nas moléculas. Veja como isso é feito no texto “Cálculo da carga formal”.