O modelo atômico de Thomson defendia que o átomo era maciço, esférico e divisível, pois era formado por um fluido de carga positiva no qual estavam dispersas partículas de carga negativa, os elétrons. Mas como ele descobriu que existiam elétrons nos átomos? Isso foi possível graças a um experimento bastante interessante. Vejamos do que se trata:
.jpg)
Modelo para o átomo de Thomson
Thomson realizou seu experimento em 1897 e usou como principal ferramenta um instrumento conhecido como ampola de Crookes ou tubo de raios catódicos.
Esse dispositivo foi criado pelo físico inglês Willian Crookes (1832-1919) em 1856. O tubo de Crookes era composto de uma ampola de vidro totalmente vedada. Dentro dele eram colocados gases sob baixa pressão e, em cada extremidade, ficava um eletrodo, isto é, de um lado havia um fio de metal ligado ao polo positivo de uma fonte de alta tensão, o ânodo, e do outro havia outro metal, chamado de cátodo, que estava ligado ao polo negativo.
Ao ligar a alta tensão, era possível observar um fluxo luminoso saindo do cátodo e indo em direção retilínea ao ânodo. Esse feixe passou a ser chamado de raio catódico.
O procedimento realizado por Thomson foi basicamente o seguinte: ele colocou campos elétricos e magnéticos na região externa à ampola de Crookes e observou que, ao serem submetidos a esses campos, os raios catódios sofriam um desvio na sua trajetória, indo em direção ao polo positivo.
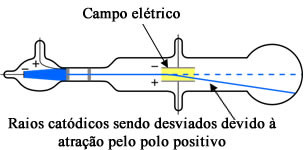
Experimento de Thomson com tubo de raios catódicos
Com esse experimento, ele pôde fazer três proposições importantes sobre os raios catódicos:
1- Possuíam carga negativa: Visto que esses raios eram desviados na direção do polo positivo, Thomson concluiu que eles eram constituídos por partículas negativas (cargas opostas atraem-se);
2- Possuíam massa: Ao colocar uma pequena hélice dentro do tubo, os raios catódicos movimentavam-na, mostrando assim que eram partículas com massa;
3- Eram um componente do átomo: Ele realizou esse experimento para vários tipos de gases e sempre acontecia o mesmo. Além disso, os resultados do experimento levaram-no a determinar o valor da relação entre a carga do elétron e a sua massa (e/m = 1,758805 . 1011 C . kg-1). Thomson observou que esse valor sempre era o mesmo e que não dependia da natureza do gás. Assim, ele constatou que aquelas partículas negativas faziam parte de toda matéria, ou seja, eram parte do átomo.
E foi assim que Thomson descobriu a primeira partícula subatômica, o elétron, e, com isso, determinou o seu modelo atômico.
* Imagem com direitos autorais: Kurzon / Wikimedia Commons.
Aproveite para conferir nossa videoaula sobre o assunto: