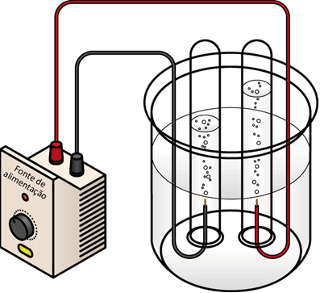
Essa técnica é utilizada com duas finalidades principais, a primeira é proteger o metal do qual a peça é feita, pois ele é revestido por um metal mais nobre, isto é, que é menos reativo e resiste mais à corrosão (oxidação). A segunda finalidade é tornar o objeto mais bonito, principalmente quando ele é revestido com ouro ou prata.
As principais galvanoplastias que podem ser feitas são a niquelação (revestimento com níquel), a cromeação (com cromo), a prateação (com prata) e a douração (com ouro).
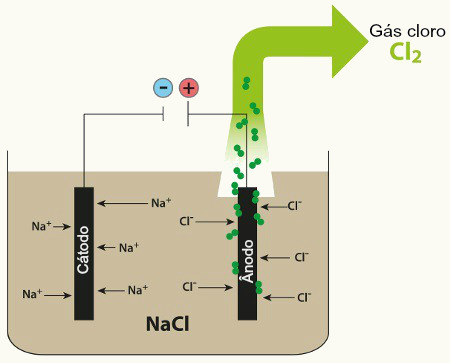
A galvanoplastia é feita principalmente nos seguintes casos:
- Na douração e na prateação de joias;
- Muitas vezes, as medalhas usadas para premiar atletas em competições são feitas de um material mais barato e depois são revestidas com ouro, por exemplo;
- Para-choques e grades dianteiras de alguns carros são cromados;
- Niquelação de torneiras;
- Rodas de automóveis são recobertas de zinco metálico.

Para se realizar a galvanoplastia de qualquer objeto, basta colocá-lo no lugar do cátodo num circuito de eletrólise, sendo que o ânodo deve ser feito de uma placa do metal que se deseja revestir a peça ou então ser inerte, e a solução aquosa eletrolítica deve ser feita de um sal desse metal.
Por exemplo, digamos que queremos realizar a douração de um anel feito de alumínio. Precisaremos de um sistema parecido com o apresentado abaixo, em que o ânodo é uma placa de ouro, o cátodo é o anel que queremos revestir e a solução eletrolítica na qual os eletrodos estão mergulhados é de nitrato de ouro III [Au(NO3)3].
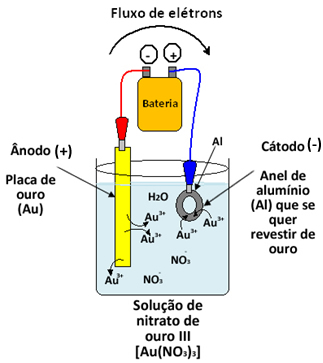
Veja que o ânodo fica ligado ao polo negativo da bateria e o cátodo ao polo positivo. Com a passagem de corrente elétrica no circuito, no ânodo haverá oxidação do próprio ouro metálico (Au), conforme a semirreação abaixo:
Semirreação do Ânodo: Au → Au3++ 3e-
No cátodo haverá a redução do cátion Au3+ e deposição de ouro sobre o anel:
Semirreação do Cátodo: Au3++ 3e- → Au
Na reação global, temos:
Semirreação do Ânodo: Au → Au3++ 3e-
Semirreação do Cátodo: Au3++ 3e- → Au
Reação Global: Zero
Isso quer dizer que não houve transformação química, mas apenas um transporte de ouro do ânodo para o cátodo.
Poderíamos também colocar no lugar da placa de ouro um eletrodo inerte, como uma placa de platina. Dessa forma, a deposição de ouro sobre o anel seria proveniente não do ânodo, mas sim dos cátions Au3+ vindos da solução:
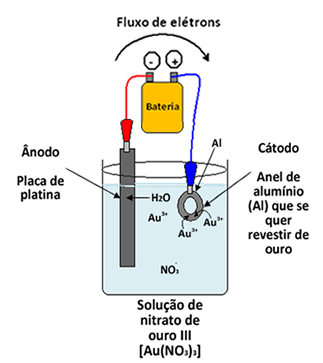
Semirreação do Ânodo: H2O →2 H++ ½ O2 + 2 e-
Semirreação do Cátodo: Au3++ 3e- → Au