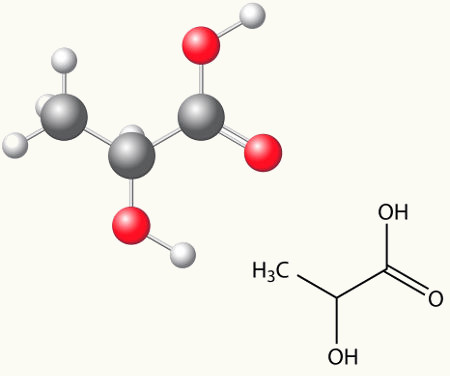
A isomeria óptica estuda o comportamento das substâncias quando submetidas a um feixe de luz polarizada*, que pode ser obtida a partir da luz natural (luz não polarizada).
Os primeiros cientistas que passaram a trabalhar com a luz polarizada foram Malus e Huygens, em 1808. Eles observaram que quando uma luz não polarizada, isto é, uma luz natural, era incidida sobre um cristal transparente de uma variedade do carbonato de cálcio (CaCO3), chamado de espato da Islândia, o feixe de luz se tornava polarizado.
Alguns anos mais tarde, em 1812, o físico Jean Baptiste Biot descobriu que determinadas substâncias tinham a capacidade de rotacionar ou desviar o plano da luz polarizada, sendo que algumas faziam isso para a direita e outras para a esquerda. Outra grande contribuição dada por ele foi que, em 1815, ele percebeu que não eram só as formas cristalinas que rotacionavam o plano da luz polarizada, mas também alguns líquidos (terebintina e alguns óleos naturais, como extrato de limão e louro) e também soluções alcoólicas de cânfora, de alguns açúcares e de ácido tartárico.
Essa descoberta foi importante, pois observou-se que as soluções aquosas também desviavam o plano da luz. Isso queria dizer que não era a estrutura cristalina ou um arranjo especial do líquido, mas sim a própria estrutura molecular do composto que causava esse fenômeno.
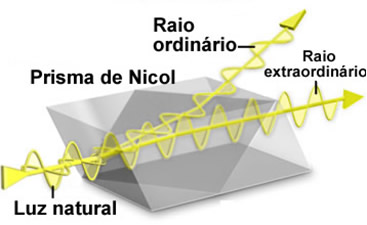
Biot usou um aparelho denominado polarímetro para observar como isso ocorria. Esse aparelho foi aperfeiçoado por Ventzke, por adaptar ao aparelho um prisma de Nicol. O funcionamento desse prisma baseia-se na propriedade que a calcita (carbonato de cálcio cristalino) tem de produzir uma dupla refração. Isso significa que quando um feixe de luz natural é incidido sobre esse cristal, saem dois raios polarizados refratados perpendicularmente, chamados de raio ordinário eraio extraordinário.

Para eliminar um dos raios é preciso cortar o cristal em medidas extremamente precisas e colá-los novamente com uma resina denominada bálsamo do Canadá. O raio ordinário, então, atinge essa resina e, como ela é mais refringente que o cristal, o raio é refletido. Somente o raio extraordinário atravessa o prisma, dando origem à luz polarizada.
Abaixo temos uma imagem de um polarímetro moderno:

No entanto, o cientista que finalmente conseguiu explicar por que esse fenômeno ocorria foi Louis Pasteur (1822-1895). Ele estabeleceu uma relação entre a assimetria estrutural e a capacidade de as substâncias se desviarem no plano de polarização.
Durante o processo de fermentação do suco de uva com a finalidade de se produzir vinho, forma-se o ácido tartárico, que é uma substância capaz de provocar um desvio da luz no sentido horário (para a direita). Depois se descobriu que uma forma do ácido tartárico, que Gay-Lussac chamou de ácido racêmico (vem do latim racemus, que significa “cacho de uva”), não causava rotação no plano da luz polarizada, era inativa.
Louis Pasteur passou então a estudar essas substâncias e viu que as duas substâncias apresentavam a mesma fórmula molecular e as mesmas propriedades, mas tinham atividades ópticas diferentes.
Posteriormente, ele percebeu que os cristais de sais de ácido tartárico eram todos iguais, mas os vindos do ácido racêmico eram de dois tipos distintos. Assim, ele separou esses cristais e analisou seu comportamento óptico em soluções aquosas. O resultado foi que uma das soluções rotacionava a luz polarizada no mesmo sentido que o ácido tartárico (para a direita); já a outra o fazia em sentido contrário (para a esquerda). Viu-se também que a mistura de soluções com iguais quantidades dos diferentes cristais era inativa sob luz polarizada. Com isso, ele concluiu que o ácido racêmico era na verdade uma mistura de:
- 50% de um tipo de ácido tartárico (que desvia o plano de luz polarizada para a direita, sendo chamado de dextrogiro);
- 50% de outro tipo de ácido tartárico (que provoca o desvio para a esquerda, sendo chamado de levogiro).
A seguir temos os cristais diferentes do ácido tartárico (enantiômeros) e as fórmulas estruturais dos isômeros dextrogiro e levogiro.
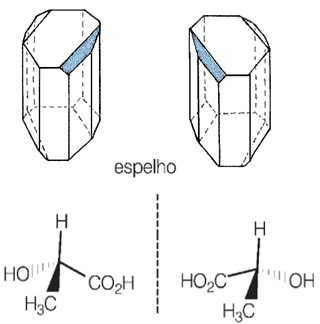
Por possuírem atividades ópticas diferentes, eles são denominados isômeros ópticos.
Além disso, essas substâncias que possuem a mesma fórmula molecular (mas cujos arranjos espaciais dos átomos são como que imagens um do outro no espelho, não sendo sobreponíveis) são conhecidos como enantiômeros.
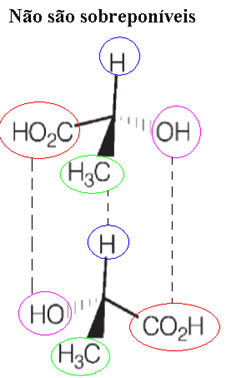
Esses experimentos de Pasteur mostraram que obviamente havia uma estreita correlação entre configuração molecular, atividade óptica e estrutura cristalina. Entretanto, isso só foi esclarecido pelos trabalhos de Van´t Hoff e Le Bel. Em 1874, eles criaram o modelo tetraédrico do carbono, mostrando que se os vértices desse tetraedro do carbono estiverem ocupados por ligantes diferentes, pode-se admitir a existência de duas moléculas diferentes e assimétricas.
*Para um estudo mais completo sobre o que constitui um feixe de luz polarizada, leia o texto “Luz polarizada e não polarizada” em nosso site.