A lei da velocidade para as reações químicas diz que a velocidade de uma reação é diretamente proporcional ao produto das concentrações dos reagentes em mols por litro, elevadas a seus expoentes que são determinados experimentalmente. Isso é expresso pela equação abaixo:
---------------------------
v = k [A]x[B]y
---------------------------
O k é uma constante de velocidade característica para cada reação.
Se a reação for elementar, isto é, com uma única etapa, os expoentes x e y serão iguais aos respectivos coeficientes, como no caso da reação abaixo:
2 NO(g) + 1 Br2(g) → 2 NOBr(g)
v = k [NO]2[Br2]1
No entanto, em reações não elementares (reações que ocorrem em várias etapas), os coeficientes da equação química não serão iguais aos expoentes da equação da variação da velocidade.
Como faremos então para determinar a expressão da velocidade de uma reação não elementar?
Conforme já dito, isso é feito com os dados experimentais. Vejamos um exemplo em que o mecanismo da reação envolve no mínimo duas etapas:
Reação analisada: NO2(g) + CO(g) → CO2(g) + NO(g)
Etapa lenta: NO2(g) + NO2(g) → NO(g) + NO3(g)
Etapa rápida: NO3(g) + CO(g) → CO2(g) + NO2 (g)
Foram feitos três experimentos com essa reação, mudando as concentrações dos reagentes. Os seguintes dados foram obtidos:
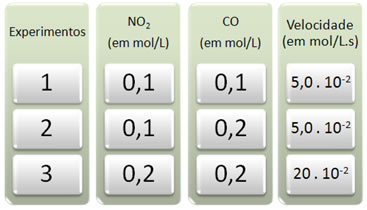
Vamos analisar primeiro o que ocorre com o CO em todos os experimentos.
Note que do primeiro para o segundo experimento, a concentração de CO dobrou, foi de 0,1 para 0,2 mol/L. Porém, isso não alterou a velocidade da reação, que permaneceu constante em 5,0 . 10-2 mol/L.s. Por isso, podemos concluir que a ordem de reação do CO é igual a zero e ele não participa na equação da velocidade.
Agora vejamos o que ocorreu com o NO2. Do primeiro para o segundo experimento, a concentração dele permaneceu constante, não influenciando na velocidade da reação. No entanto, ao considerarmos do segundo para o terceiro experimento, veremos que sua concentração dobrou (foi de 0,1 para 0,2 mol/L) e como consequência a velocidade da reação quadruplicou (foi de 5,0 . 10-2 para 20 . 10-2 mol/L.s).
Dessa forma, concluímos que a ordem de reação do NO2 é igual a 2 (isto é 4/2 = 2). Assim, temos:
v = k [NO2]2
Essa é a equação da velocidade da reação, já que o CO não participa.
Note que, na reação, o coeficiente do NO2 é 1; e na equação da velocidade, é 2. No caso do CO também deu diferente: na reação seu coeficiente é 1 e sua ordem de reação é igual a zero. Por isso é importante realizar os experimentos.
Essa análise nos mostra também qual é a etapa do mecanismo mais influente na velocidade da reação. No caso é a etapa lenta, pois é nela que temos:
NO2(g) + NO2(g) → NO(g) + NO3(g)
E a equação da velocidade corresponde a essa etapa:
v = k [NO2] [NO2] ou v = k [NO2]2







