O magnésio é um elemento químico que possui número atômico igual a 12. Ele pertence à família 2 da tabela periódica, sendo, portanto, um metal alcalinoterroso.
Ele não é encontrado livre na natureza em seu estado nativo, mas sim na forma de compostos. A obtenção do magnésio é feita industrialmente através da mesma técnica com a qual ele foi obtido pela primeira vez: a eletrólise ígnea do cloreto de magnésio (MgCl2), em 1808, por Humphry Davy. O cloreto de magnésio é encontrado na água do mar ou em jazidas de sal. Nesse processo, esse composto é fundido, ficando livres os íons Mg2+ e Cl-.
MgCl2 → Mg2+ + 2 Cl-
A partir disso, passa-se uma corrente elétrica por esse líquido iônico que provoca as seguintes reações de redução e oxidação:
Cátodo (redução): Mg2+ + 2 e- → Mg
Ânodo (oxidação): 2 Cl- → Cl2 + 2 e-
Reação global: MgCl2 → Mg + Cl2
Veja que esse processo origina também o gás cloro.
O magnésio é um sólido de baixa densidade em condições ambientes e com coloração branco-prateada. Ao ser queimado, forma-se o óxido de magnésio por meio de uma reação de síntese ou adição com o oxigênio presente no ar:
2 Mg + O2 → 2 MgO
Ao observar essa reação, nota-se uma grande liberação de luz branca, que já foi muito utilizada em flashes fotográficos descartáveis e foguetes sinalizadores.

A queima do magnésio emite uma luz branca forte
O metal magnésio pode ser misturado com outros metais para a formação de ligas metálicas. Entre elas, temos o magnálio, que é formado por 90% de alumínio e 10% de magnésio. Por ser bastante leve, ele é usado em peças de aviões e de automóveis.
O magnésio é o oitavo elemento em abundância na crosta terrestre. Veja alguns de seus compostos e suas aplicações a seguir:
* Sulfato de magnésio (MgSO4): é muito conhecido como sal-amargo ou como sal de Epsom. Ele recebeu esse nome em virtude de sua descoberta, que ocorreu em 1618 em Epsom, Surrey, na Grã-Bretanha. Estava ocorrendo uma seca naquela região quando Henry Wicker observou que, apesar disso, o gado não bebia uma água que havia em um buraco. Isso porque era uma água amarga, da qual foi retirado o sal de Epsom. Ele possui ação laxativa e é usado para massagens e banhos relaxantes.
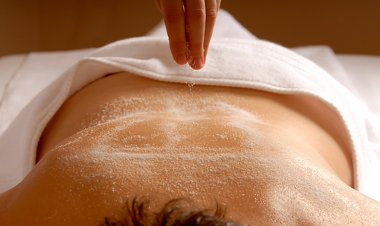
O sal de Epsom é usado como sal em massagens
* Hidróxido de magnésio (Mg(OH)2): Pode ser obtido por meio do mineral brucita ou pela decomposição térmica da magnesita e reação com vapor de água. Sua principal aplicação é em suspensão aquosa, formando o leite de magnésia, usado como antiácido estomacal em pequenas quantidades.
* Silicato de magnésio: Mais conhecido como talco ou “pedra-sabão”, é muito utilizado em esculturas. Antônio Francisco Lisboa, mais conhecido como Aleijadinho, era um artista que a usava muito. Além disso, para revestir a estátua do Cristo Redentor, a pedra-sabão também foi escolhida, porque mesmo sendo frágil, ela não deforma e resiste ao tempo.

A estátua do Cristo Redentor foi revestida com pedra-sabão *
* Carbonato de magnésio (MgCO3): Constituinte do mineral magnesita mostrado na figura a seguir. É muito usado na fabricação de material refratário e isolante.

Magnesita (carbonato de magnésio – MgCO3)
* Amianto ou asbestos: Existem mais de 30 tipos de silicatos fibrosos naturais encontrados no solo. Entre eles, os principais são: (1) Serpentinas (amianto branco) constituídas do mineral crisotilo (Mg3Si2O5(OH)4) e (2) Anfibólios (amiantos marrom, azul e outros) constituídos dos minerais tremolita (Ca2Mg5Si8O22(OH)2) e amosita ((Fe, Mg, Ca)OSiO2 . n H2O).

As fibras de amianto ou asbesto possuem magnésio em sua constituição
Esse mineral possui várias propriedades físico-químicas importantes, por isso seu uso é bastante difundido na fabricação de telhas, tanques, caixas d’água, em diversos produtos da construção civil e para isolar termicamente máquinas e equipamentos. Mas por ser uma fibra comprovadamente cancerígena, essas aplicações são proibidas em muitos países.
O íons magnésio (Mg2+) desempenham papeis vitais em nosso organismo, destacando-se a regulação dos movimentos através das membranas, constituição de enzimas que liberam energia dos alimentos e participação na construção de proteínas. Nós precisamos de um suprimento diário de 200 mg de magnésio, que pode ser obtido facilmente porque a maioria dos alimentos contém-no. Dentre os alimentos mais ricos em magnésio, destacam-se as amêndoas, castanhas, caju, soja, farelo, chocolate e levedura de cerveja.

Fontes de magnésio na alimentação
O magnésio também é muito importante para as plantas, pois ele está presente na clorofila, sendo responsável pela captação de energia do sol para a realização da fotossíntese.
* Imagem com direitos autorais: earlytwenties / Shutterstock.com.












