A massa molecular é a soma das massas atômicas de determinada espécie química.
A unidade utilizada é a mesma usada na massa atômica, que é a unidade de massa atômica (u). 1 u é igual a 1,66 . 10-24g.
Visto que 1 u corresponde a 1/12 da massa do carbono-12, a massa molecular indica quantas vezes a massa da molécula é maior que 1/12 da massa do isótopo do carbono-12. Por exemplo, considerando o exemplo da molécula do dióxido de carbono (CO2), sua massa molecular é 44 u, isto é, ela é 44 vezes maior que 1/12 da massa do 12C.
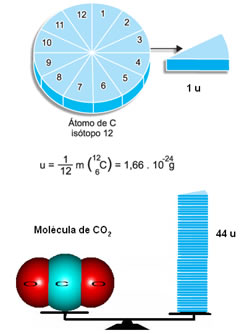
Mas como se sabe que a massa molecular do CO2 é 44 u?
O cálculo é feito somando-se as massas atômicas dos átomos que compõem a molécula. A massa atômica do carbono é 12 u; e do oxigênio é 16 u. Porém, temos que levar em consideração também a quantidade de átomos desses elementos que aparecem na molécula. Como só temos um carbono, a sua massa atômica continuará com o mesmo valor. Já a massa atômica do oxigênio será multiplicada por 2, pois a molécula contém dois átomos de oxigênio. Desse modo, o cálculo é realizado da seguinte forma:
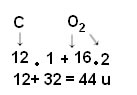
A seguir temos outros exemplos de cálculos de massas moleculares:
MM (CH4)= (1 . 12) + (4 . 1) = 12 + 4 = 16 u
MM (SO2)= (1 . 32) + (2. 16) = 32 + 32 = 64 u
MM (H2O)= (2 . 1) + (1 . 16) = 2 + 16 = 18 u
MM (C2H6)= (2 . 12) + (6 . 1) = 24 + 6 = 30 u
MM (H2SO4)= (2 . 1) + (1 . 32) + (4 . 16)= 2 + 32 + 64 = 98 u
MM (C12H22O11)= (12 . 12) + (22 . 1) + (11 . 16)= 144 + 22 + 176 = 342 u
Em todos os casos temos moléculas, ou seja, compostos formados por meio de ligações covalentes entre seus átomos. Porém, quando se trata de substâncias que não são formadas por moléculas, como as iônicas, não convém usar o termo massa molecular. Nesse caso, a denominação dada é massa-fórmula, embora muitas vezes o termo massa molecular seja utilizado tanto para compostos moleculares como para iônicos, porque o raciocínio do cálculo é o mesmo.
A seguir temos o exemplo desse cálculo para o pirofosfato de sódio:
MM (Na4P2O7)= (4 . 23) + (2 . 31) + (7 . 16)= 92 + 62 + 112 = 266 u
No caso de substâncias hidratadas, calculam-se separadamente as massas moleculares da água envolvida e da molécula e, posteriormente, esses valores são somados. Veja o cálculo da seguinte substância penta hidratada: CuSO4 . 5 H2O.
MM (CuSO4 . 5 H2O)= Cu S O4 . 5 H2O
MM (CuSO4 . 5 H2O)= (1 . 63,5) + (1 . 32) + (4.16) + 5 (1 . 2 + 1 . 16)
MM (CuSO4 . 5 H2O) = (63,5 + 32 + 64) + (5 . 18)
MM (CuSO4 . 5 H2O) = 159,5 + 90
MM (CuSO4 . 5 H2O) = 249,5 u
Aproveite para conferir nossas videoaulas relacionadas ao assunto: