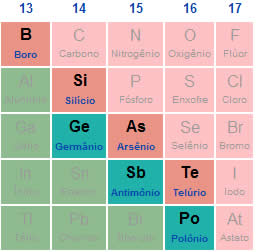
O polônio é um elemento químico de número atômico 84, pertence ao 6º período da família 16 (calcogênios) da tabela periódica, tem massa molar de 208,98 g/mol, temperatura de fusão igual a 254 ºC e temperatura de ebulição igual a 962 ºC, portanto, encontra-se no estado sólido em temperatura ambiente (cerca de 25ºC).

Átomo de polônio
Esse elemento é radioativo e possui sete isótopos naturais, que são: 216Po e 212Po (provenientes da série do decaimento do 232Th), 215Po e 211Po (provenientes da série de decaimento do 235U) e 218Po, 214Po e 210Po (provenientes da série do decaimento do 238U). Com exceção do isótopo 210Po, que é o mais abundante na natureza e que possui meia-vida de 138,376 dias, todos os demais possuem meias-vidas muito curtas.
A descoberta do polônio foi realizada pelo casal mais conhecido no estudo da radioatividade, Pierre Curie (1859-1906) e Marie Curie (1867-1934). Até então, os únicos elementos radioativos conhecidos eram o urânio e o tório. Mas em abril de 1898, o casal Curie observou que dois minérios do urânio, a pechblenda (óxido de urânio) e a calcolita (fosfato de cobre e uranila), eram bem mais radioativos que o próprio urânio. Isso só podia significar que havia algum outro elemento químico mais radioativo que o urânio.
O governo austríaco providenciou uma tonelada de pechblenda para o casal Curie. Depois de um trabalho bastante árduo, eles conseguiram isolar um novo elemento químico que era 400 vezes mais radioativo que o urânio. Em 18 de julho de 1898, eles enviaram um relatório para a Academia de Ciências de Paris que foi lido por Henri Bequerel. Nesse relatório, eles comunicavam sobre o novo elemento descoberto, ao qual deram o nome de Polônio em homenagem à terra natal de Marie Curie, a Polônia. Provavelmente ela pretendia com isso chamar a atenção para o seu país que, até então, não era independente, mas era partilhado pelo império russo, alemão e austro-húngaro.
A título de curiosidade, é interessante citar que o casal Curie continuou com seu trabalho, pois eles observaram que a radiação emitida pelos minérios eram ainda maiores que a emitida pelo polônio e urânio juntos, o que resultou na descoberta do quarto elemento radioativo, o rádio. Ele recebeu esse nome porque era duas milhões de vezes mais radioativo que o urânio.
A descoberta desses elementos químicos rendeu à Marie Curie o Prêmio Nobel de Química em 1911. Ela ganhou também o Prêmio Nobel de Física em 1913.

Selo francês mostrando Marie Curie, que ganhou dois prêmios Nobel em Física e Química por seu trabalho com radioatividade e a descoberta de elementos
Isso nos mostra que a ocorrência natural do polônio é, em sua maioria, nos minerais de urânio. Na crosta terrestre, a abundância desse elemento é de 2 . 10-10 mg/kg; já no mar, a sua abundância é de 1,5 . 10-14 mg/L. A presença do polônio-210 em águas superficiais (rios e lagos) vem da deposição atmosférica desses radionuclídeos, que são produzidos pelo decaimento do 222Rn e também pela lixiviação das rochas. Já em poços rasos, ele é oriundo do arraste das águas das chuvas e também da lixiviação das rochas próximas.
Conforme já mencionado, em condições ambientes, o polônio é sólido, possui brilho metálico parecido com o do chumbo (sendo considerado um semimetal, pois possui propriedades intermediárias entre os metais e os ametais) e também conduz corrente elétrica como os metais, todavia, fragmenta-se facilmente como os ametais.
Ele dissolve-se bem em ácidos, formando soluções com íons Po2+, e pode chegar ao Nox +4 quando em ácidos oxidantes concentrados. O polônio também reage com soluções alcalinas (básicas) e com halogênios, produzindo haletos.
O 210Po emite, em sua maioria, partículas alfa de energia de 7,6 MeV, mas emite também doze grupos de partículas de longo alcance que vão de 8,2 a 10,5 MeV. As emissões alfa do polônio não são perigosas quando se encontram fora do organismo, porque elas possuem baixo poder de penetração. Como mostra o texto Radiações alfa, beta e gama, essas partículas não conseguem atravessar nem mesmo uma folha de papel.
No entanto, se for ingerido ou inalado, pode representar riscos, pois ele possui meia-vida de 50 dias no organismo, levando ao desenvolvimento de câncer de pulmão. Inclusive, as folhas de fumo absorvem o polônio presente no ar proveniente do decaimento do radônio e também o absorvem pelas raízes. O resultado é que o cigarro possui esse elemento e leva os seus usuários a desenvolverem câncer de pulmão.
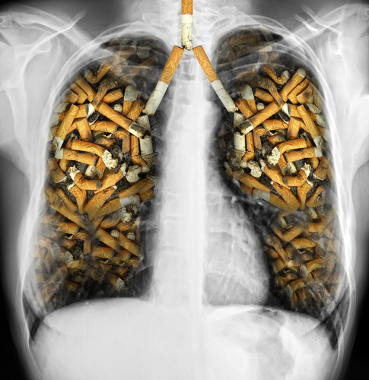
O cigarro possui polônio, o que pode causar câncer de pulmão
Além de radioativo, o polônio é também muito tóxico. Tanto que ele foi usado como veneno em 2006 para matar o ex-espião russo da KGB, Alexander Litvinenko.
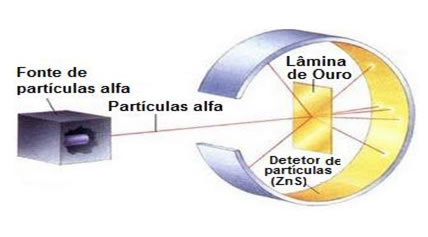
Mas o polônio também possui aplicações benéficas. Ele é usado, por exemplo, como fonte de nêutrons quando misturado ou em forma de liga com o berílio. Ele foi a fonte radioativa usada no Experimento de Rutherford, que resultou na descoberta da estrutura atômica e em um novo modelo atômico (leia o texto O átomo de Rutherford).
Ele também é usado pela indústria para eliminar eletricidade estática causada pela laminação de papel, manufatura de plásticos e fiação de fibras sintéticas; é selado em escovas ou pincéis que removem a poeira de filmes fotográficos e lentes de câmeras; é usado para melhorar a performance das velas de motores de combustão interna e vem sendo estudado como possível fonte de calor para a fabricação de pilhas termoelétricas de pouco peso que seriam usadas em satélites artificiais.