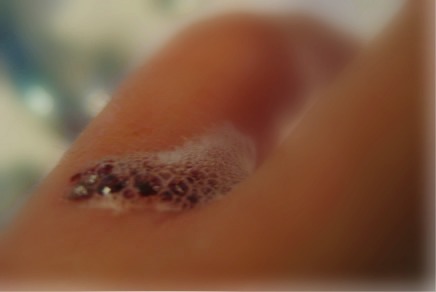
Quem, principalmente quando criança, nunca passou água oxigenada nos machucados, ferimentos e cortes? Praticamente todo mundo já passou por esse tipo de experiência.
Realmente, a água oxigenada é um produto usado muitas vezes como bactericida e, por isso, a maioria das pessoas conhece o fenômeno que ocorre quando ela entra em contato com o ferimento: há uma intensa efervescência. Várias pessoas dizem que essa espuma formada indica a presença de infecção. Mas será que é isso mesmo?
Bom, na realidade essa efervescência observada se trata da decomposição da água oxigenada, que é uma solução aquosa de peróxido de hidrogênio (H2O2(aq)). Essa reação é mostrada abaixo:
H2O2(aq) → H2O(l) + O2(g)
Essa decomposição da água oxigenada ocorre no meio ambiente, porém de forma lenta. Visto que ela ocorre naturalmente, é por isso que geralmente a água oxigenada é guardada em frascos escuros, longe da claridade, isto é, para não se decompor.
Mas essa reação pode ser acelerada se usarmos alguns catalisadores. Catalisador é uma substância que diminui a energia de ativação de uma reação química, fazendo, assim, com que ela se processe de forma mais rápida. O catalisador só aumenta a velocidade da reação, mas não participa dela como um produto, sendo totalmente regenerado no final.
Um catalisador que pode ser usado nesse caso é o dióxido de manganês (MnO2). Observe abaixo como a velocidade da decomposição da água oxigenada acelera:

Outro catalisador que aumenta muito a velocidade dessa reação é uma enzima denominada catalase. Ela está presente em nosso sangue, assim, quando adicionamos água oxigenada em algum ferimento, é essa enzima que funciona como catalisadora da reação de decomposição da água oxigenada, aumentando sua velocidade. Isso é visível pela efervescência que se produz, pois o volume de bolhas de oxigênio formadas será muito maior.
Se aplicarmos repetidas vezes a água oxigenada sobre o machucado, veremos que ela continuará borbulhando, o que prova que não é em razão da presença de infeccção que sua espuma surge.
Além disso, a batata, o fígado e bactérias do tipo estafilococos também contêm a enzima catalase. Portanto, se a água oxigenada entrar em contato com algum desses produtos ela irá efervescer. Inclusive, esse procedimento é usado em laboratório para diferenciar bactérias estafilococos das do tipo estreptococos, sendo que essa última não possui catalase e, consequentemente, não faz a água oxigenada efervescer.
Se adicionarmos um pedaço de batata à água oxigenada, veremos que a decomposição dessa substância é acelerada, provando que há a presença da enzima catalase na batata.