É verdade que o sal ou cloreto de sódio (NaCl) e o diamante são ambos cristais, isto é, possuem estruturas cristalinas organizadas em arranjos espaciais. Porém, a característica fundamental que diferencia um composto do outro e que é responsável pelas características de cada um, como a dureza, é a ligação química que dá origem a cada uma dessas substâncias.
Eles possuem ligações químicas diferentes. A ligação química que dá origem ao diamante é a ligação covalente, molecular ou homopolar. Já a ligação que existe no sal comum de cozinha é a ligação iônica, eletrovalente ou heteropolar. Vejamos como ocorre cada uma dessas e como são formados seus cristais:
- Sal:
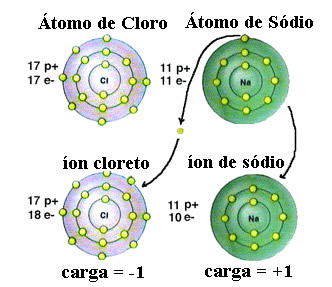
Conforme já dito, o sal é na realidade o cloreto de sódio formado pela ligação iônica entre um átomo de sódio (Na) e um de cloro (Cl). Segundo a Teoria do Octeto, para um elemento ficar estável ele precisa adquirir configuração de gás nobre, isto é, ter oito elétrons na sua camada de valência ou dois elétrons no caso dos que possuem apenas uma camada eletrônica. Assim, veja a representação desses dois elementos citados:
.jpg)
Observe que o átomo de cloro possui no total 17 elétrons, e que na sua última camada ele possui sete elétrons. Desse modo, ele precisa receber mais um elétron para ficar estável. Já o átomo de sódio possui apenas um elétron na sua camada de valência, portanto, o sódio precisa perder esse elétron para que sua última camada fique com oito elétrons.
Dessa maneira, o sódio cede definitivamente um elétron para o átomo de cloro, estabelecendo a ligação iônica, em que ambos ficam estáveis. Isso é ilustrado na imagem a seguir:
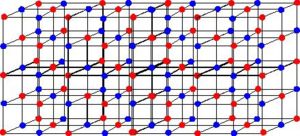
A representação que fizemos até aqui serve para ver o que ocorre entre apenas dois átomos. Na realidade, porém, uma reação envolve um número enorme de átomos, de modo que no final se obtém um aglomerado que envolve um número enorme de íons. A arrumação geométrica desses íons forma grades, redes ou reticulados cristalinos que são os cristais aos quais nos referimos no início do texto. Olhando com um microscópio de varredura é possível visualizar os cristaizinhos do sal, que são retículos iônicos de forma cúbica.

- Diamante:
O diamante é formado, na realidade, por macromoléculas covalentes, que são “estruturas gigantes”, nas quais se encontra um número enorme de átomos de carbono reunidos por ligações covalentes.
Ligações covalentes são diferentes das iônicas, porque nas ligações iônicas um dos átomos doa definitivamente um ou mais elétrons para o outro com a formação de íons. Já na ligação covalente há um compartilhamento de elétrons e não há a formação de íons.
Na ilustração abaixo podemos ver a estrutura do diamante que leva ao seu estado cristalino:
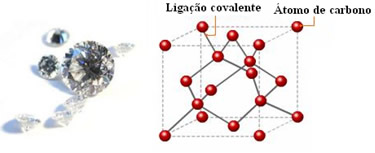
As ligações covalentes realizadas pelos átomos de carbono do diamante são muito mais fortes que as ligações iônicas do sódio e do cloro no sal, isto é, a força de atração que mantém seus átomos unidos é bem maior, necessitando de muito mais energia para quebrá-la. Isso torna o diamante vencedor, por assim dizer, quando se trata da “força”. É por isso que, apesar de ambos serem cristais, o diamante apresenta maior dureza.