Quando dois ou mais gases são misturados, obtém-se uma mistura homogênea em todos os casos. Porém, a pressão parcial dos gases não será igual à pressão total da mistura em questão.
Mas, primeiramente, vamos entender o que são as pressões parcial e total.

No entanto, a pressão parcial dos gases, que está sendo citada, é a pressão que esses gases exercem dentro da mistura gasosa e não é a mesma pressão que eles exerciam antes de entrarem na mistura, quando estavam isolados.
E a pressão total? Segundo a lei de Dalton das pressões parciais para misturas gasosas, a pressão total é obtida por meio da somatória das pressões parciais dos gases componentes da mistura:

Para entendermos como isso se aplica, pense em um pneu de carro que foi calibrado em um lugar com pressão de 1,0 atm e cuja pressão da calibragem por meio do compressor de ar foi de 2,0 atm. O ar é uma mistura de gases, em que os principais são o nitrogênio, que corresponde a cerca de 80% da composição do ar; e o oxigênio, que corresponde a quase 20% do ar.
Conforme foi mostrado pelo compressor de ar, a pressão total é de 2,0 atm. Sendo que 80% são de nitrogênio, portanto, o nitrogênio exerce pressão parcial de 1,6 atm. E 20% são de oxigênio, dando 0,4 atm. Note que se somarmos as pressões parciais, dará exatamente o valor da pressão parcial.
Aplicando a lei de Dalton para a equação de estado, temos:
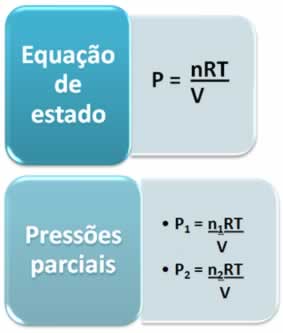
Observe que as pressões parciais são diretamente proporcionais aos números de mols (n). Assim, a pressão total também é diretamente proporcional à somatória do número total de mol (Σn):

Além disso, outra grandeza química importante é a fração molar (X), também denominada fração em quantidade de matéria ou, ainda, fração em mol. Ela corresponde à relação existente entre um valor molar parcial e um valor total.
Para entendermos melhor, voltemos ao exemplo do ar dentro dos pneus calibrados. Já que o nitrogênio ocupa 80% do volume da mistura, podemos dizer que em 1,0 mol, ele corresponde a 0,8 mol. Nesse caso, a fração molar será dada pela relação entre a quantidade em mol do nitrogênio pelo valor total:
Xnitrogênio = nnitrogênio
Σn
Xnitrogênio = 0,8 mol = 0,8
1,0 mol
A fração molar é correspondente também à relação entre a pressão parcial do gás em questão dentro da mistura e a pressão total da mistura gasosa:
Xnitrogênio = nnitrogênio= Pnitrogênio
Σn Ptotal