Podemos usar a Tabela Periódica dos elementos químicos para relacionar algumas de suas propriedades. Entre elas, temos as propriedades periódicas e as aperiódicas. Veja o que as diferencia e quais os principais exemplos de cada uma:
- Propriedades Periódicas:
A palavra “periódica” é usada para se referir a alguma coisa que se repete em períodos regulares. Por exemplo, se toda quarta-feira você faz natação, isso é um evento periódico que se repete a cada sete dias.
De modo similar, as propriedades periódicas são aquelas que variam periodicamente ao longo da Tabela Periódica, ou seja, à medida que o número atômico aumenta, tais propriedades assumem valores semelhantes para intervalos regulares.
As principais propriedades periódicas são:
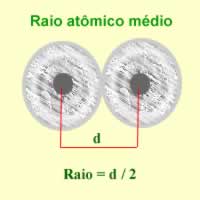
* Raio atômico;
* Energia de Ionização;
* Eletroafinidade ou Afinidade Eletrônica;
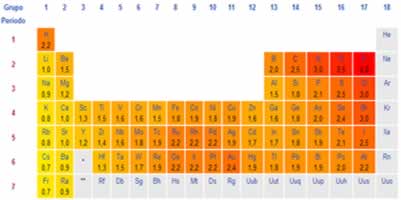
* Eletronegatividade;
* Eletropositividade;
* Ponto de fusão e ebulição;
* Densidade;
* Volume atômico.
- Propriedades Aperiódicas:
São aquelas cujos valores só aumentam ou diminuem com o número atômico, mas não obedecem à posição na Tabela, ou seja, não se repetem em períodos regulares.
Os dois principais exemplos de propriedades aperiódicas são a massa atômica e o calor específico. A massa atômica sempre aumenta com o número atômico, mas não diz respeito à posição do elemento na Tabela. O calor específico (quantidade de calor necessária para elevar em 1ºC a temperatura de 1 g do elemento) do elemento sólido sempre diminui com o aumento do número atômico.
Videoaula relacionada: