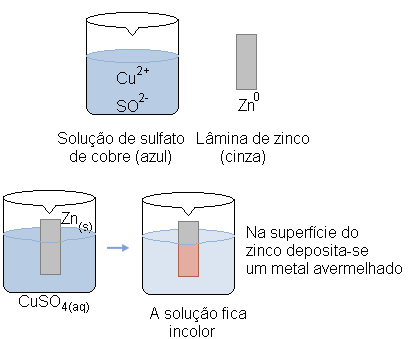
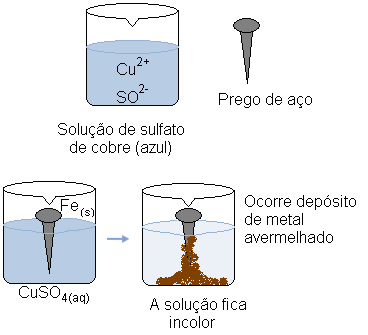
Imagine que mergulhemos um prego de aço (liga metálica predominantemente constituída de ferro) numa solução aquosa de sulfato de cobre (CuSO4(aq)). Com o tempo, notaríamos que a solução que era predominantemente azul fica incolor e forma-se um depósito de um metal avermelhado sobre o prego.
O que causou essas transformações?
Ocorreu uma transferência de elétrons, conforme se pode ver na equação dessa reação abaixo:
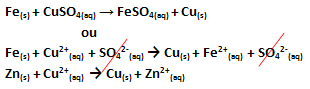
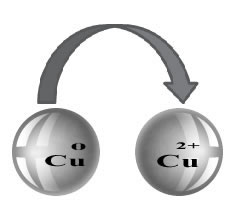
Observe que o zinco metálico (Zn(s)) perde dois elétrons e se transforma no cátion Zn2+(aq), que fica na solução aquosa. Dizemos que o ferro sofreu uma oxidação, isto é, perdeu elétrons e seu número de oxidação (Nox) aumentou (porque os elétrons têm carga negativa).
Fe(s) → Fe2+(aq) + 2e-
Ao mesmo tempo, o cátion cobre (Cu2+(aq)), que estava presente na solução aquosa, recebeu esses dois elétrons transferidos do ferro e passou a ser cobre metálico (Cu(s)). Os cátions Cu2+(aq) eram responsáveis pela coloração azul da solução. Assim, à medida que eles vão sendo consumidos, a solução torna-se incolor. O metal cobre formado deposita-se sobre o prego e forma a camada de cor avermelhada mencionada.
Dizemos que os cátions cobre sofreram uma redução, pois ganharam elétrons e seu Nox diminuiu:
Cu2+(aq) → Cu(s)
Esse é um exemplo de reação de oxirredução.
Toda reação desse tipo é caracterizada pela transferência de elétrons entre os átomos, íons ou moléculas das substâncias reagentes. Isso significa que ocorre simultaneamente uma oxidação e uma redução, ou seja, perda e ganho de elétrons, respectivamente; pois os elétrons que são perdidos por um átomo, íon ou molécula são imediatamente recebidos por outros.
Em qualquer reação de oxirredução que estiver devidamente balanceada, o número de elétrons perdidos por um reagente é exatamente igual ao número de elétrons ganhos por outro. Por isso, a espécie química que sofre a oxidação é chamada também de agente redutor, porque foi por causa de sua perda de elétrons que ocorreu a redução da outra espécie química da reação. E a espécie química que sofreu redução é chamada de agente oxidante, porque causou a oxidação da outra.
As reações de oxirredução também são muitas vezes chamadas de reações de oxidorredução e reações redox.
Baseados em tudo que foi explanado, podemos dizer que em toda reação de oxirredução haverá os seguintes elementos:

Aproveite para conferir nossa videoaula relacionada ao assunto: