A temperatura é uma das três variáveis de estado dos gases. As outras duas são a pressão e o volume.
A temperatura termodinâmica (T) é diretamente proporcional à energia cinética das partículas de um gás. Isso significa que quanto maior a agitação das partículas, maior será a temperatura e vice-versa.
Porém, uma diferença reside no fato de que a energia cinética das partículas depende da massa do gás, enquanto a temperatura não.
A temperatura dos gases e dos corpos costuma ser medida por meio de um termômetro, que possui uma graduação denominada escala termométrica. A unidade adotada pelo Sistema Internacional de Unidades e pela IUPAC (União Internacional de Química Pura e Aplicada) é o kelvin, simbolizado pela letra K. Essa escala é também denominada de escala absoluta porque o seu ponto inicial é o zero absoluto ou zero termodinâmico (0 K), temperatura em que as partículas não têm movimento. Visto que começa no zero absoluto, a escala kelvin não possui valores negativos.
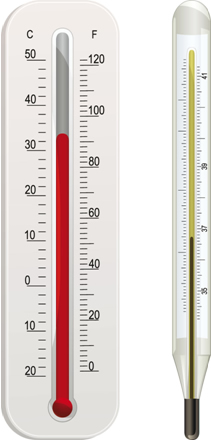
No Brasil, no entanto, a escala termométrica mais utilizada é o Celsius (ºC). Visto que 0º C equivale a 273 K e que o intervalo dessas duas escalas é o mesmo. Para transformar o grau Celsius em Kelvin, basta somar 273:
TK = T°C + 273
Exemplo: Qual é a temperatura Kelvin correspondente a 40 ºC?
Resolução:
TK = T°C + 273
TK = 40 + 273
TK = 313 K
Outra escala termodinâmica muito usada principalmente nos Estados Unidos é a escala Fahrenheit (°F). O seu intervalo é diferente, sendo que se quisermos realizar uma conversão de Fahrenheit para Celsius usamos a seguinte expressão:
TºC = (TºF – 32)
1,8
Exemplo: Qual é a temperatura em graus Celsius correspondente a 32 ºF?
Resolução:
TºC = (TºF – 32)
1,8
TºC = (32 – 32)
1,8
TºC = 0 ºC
A temperatura absoluta é diretamente proporcional à pressão. Isso pode ser visto quando medimos a pressão do ar dentro dos pneus quando eles estão quentes. Nesse caso, encontramos um valor muito maior do que se fizéssemos a medição com os pneus frios. Isso acontece porque o ar se expande com o aumento da temperatura. É por isso que o recomendado é calibrar os pneus quando eles estão frios, ou seja, com o veículo parado ou depois de ter circulado no máximo 3 km.

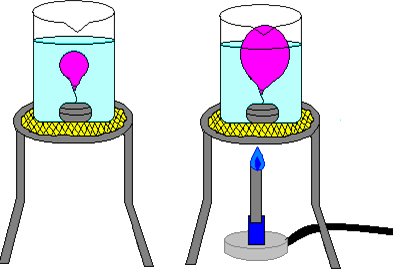
A temperatura também é diretamente proporcional ao volume. Isso pode ser visto se pegarmos um balão com ar, não muito cheio, e o colocarmos primeiro em um recipiente contendo água gelada e, depois, aquecermos a água. No momento inicial, o balão ficará com um aspecto murcho, porque com a temperatura baixa, o volume do gás é menor (ele se comprime). Mas, depois que a temperatura aumenta, o balão incha, porque o volume ocupado pelas moléculas aumentou (expandiu).