Com exceção dos gases nobres, os gases são compostos moleculares que estão muito presentes em nosso cotidiano e dos quais a vida animal e vegetal dependem.
Uma vez que não é possível ver os gases em ação, é preciso entender seu comportamento habitual. Para tal, criou-se, a partir de vários experimentos com gases, um modelo de comportamento das partículas dos gases ou uma teoria cinética dos gases, também denominada teoria do gás ideal.
Todo gás que se comporta com as características descritas abaixo é chamado de gás ideal ou perfeito. No entanto, lembre-se que, como é um modelo, sua existência não é real. Normalmente os gases estudados, chamados de gases reais, não se comportam inteiramente como um gás ideal, porque os gases interagem entre si e a teoria cinética considera que não há interações entre suas moléculas.
Além disso, é importante saber que a altas temperaturas e baixas pressões, o comportamento dos gases reais se assemelha bastante ao dos gases ideais.
Desse modo, vejamos as características gerais dos gases, segundo a teoria cinética:
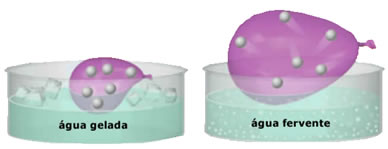
- Grande compressibilidade e capacidade de expansão. Por não apresentarem um volume fixo, os gases ocupam o volume do recipiente em que estão confinados. Além disso, o gás se dilata quando aquecido e se contrai quando resfriado.
.jpg)
- Os gases são miscíveis entre si em qualquer proporção, ou seja, apresentam grande difusibilidade;
- Os gases são formados por partículas minúsculas que apresentam grande liberdade de movimentação. De modo desordenado e contínuo, elas se chocam umas com as outras e com as paredes do recipiente, exercendo uma pressão uniforme sobre ele. Essa pressão é a intensidade da força de colisão com as paredes por unidade de área. As partículas de um gás não se depositam no solo pela ação da gravidade, uma vez que se movimentam velozmente;
- Quanto maior for o número de choques realizado pelas partículas do gás em um recipiente, maior será a pressão exercida por ele;
- O choque realizado entre as partículas do gás ideal deve ser elástico, ou seja, sem perda de energia cinética;
- Todo gás tem massa;
- O aumento da temperatura provoca um aumento na energia cinética das partículas do gás, que faz com que elas se movimentem mais rápido;
- As forças de atração intermolecular são consideradas desprezíveis;
- As três variáveis de estado dos gases são: volume, temperatura e pressão.