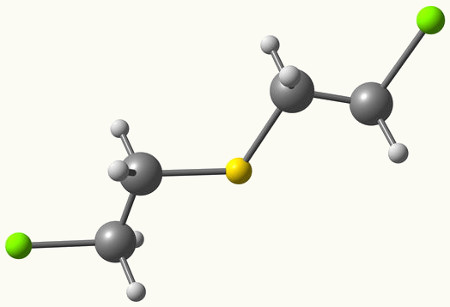
Um tioéter é um composto orgânico classificado como sulfurado pelo fato de apresentar átomos de enxofre na sua composição (S). Antes de um estudo mais detalhado sobre o assunto, é importante relembrar o que é um éter.
Os éteres são funções orgânicas oxigenadas que apresentam dois radicais orgânicos ligados a um átomo de oxigênio. Veja um exemplo:
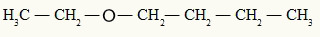
Radicais etil e propil ligados ao átomo de oxigênio
Já o tioéter sempre apresenta dois radicais orgânicos ligados a um átomo de enxofre, como podemos observar no exemplo a seguir:
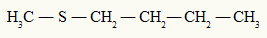
Radicais metil e butil ligados ao átomo de enxofre
Por essa razão, podemos representar um tioéter com a seguinte fórmula geral:
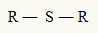
Radicais R ligados a um átomo de enxofre
A presença do átomo de enxofre como átomo central favorece que os tioéteres tenham como principais características a geometria angular e sejam moléculas mais apolares. Isso se dá pelo fato de o enxofre apresentar seis elétrons na camada de valência e utilizar apenas dois nas ligações simples com os radicais. Assim, sobram quatro elétrons que não participam das ligações, formando duas nuvens eletrônicas. De acordo com as regras de Gillespie, quando o átomo central apresentar dois ligantes e duas nuvens sobrando, a geometria da molécula será angular.
Como a maior parte da molécula (os radicais) do tioéter apresenta carbono e hidrogênio, ela é considerada apolar, sendo, por isso, insolúvel em água. Esses compostos apresentam boa solubilidade em solventes orgânicos.
A grande maioria dos tioéteres é sólida, mas os de cadeias menores são líquidos em temperatura ambiente. As demais propriedades dos tióetes sempre são avaliadas comparando-os com um éter orgânico. Por exemplo: possuem menores ponto de fusão e ebulição do que os éteres, além de serem bem menos reativos.
A regra de nomenclatura IUPAC dos tioéteres é a seguinte:
Prefixo do radical menor + tio+ prefixo do radical maior + infixo do número de carbono + infixo mais + o
Acompanhe alguns exemplos de nomenclatura de tioéteres:
1º)
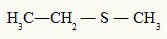
O radical menor é o metil (1 carbono) e o maior é o etil. No maior, vamos retirar o il do etil e acrescentar an + o. Assim, a nomenclatura desse composto será:
Metil-tioetano
2º)
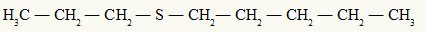
O radical menor é o propil (carbono) e o maior é o pentil. No maior, vamos retirar o il do pentil e acrescentar an + o. Assim, a nomenclatura desse composto será:
Propil-tiopentano