A isomeria é um fenômeno em que dois ou mais compostos orgânicos diferentes possuem a mesma fórmula molecular, mas se diferenciam por algum aspecto em sua fórmula estrutural. Existem dois tipos básicos de isomeria: plana (ou constitucional) e espacial (ou estereoisomeria).
Esses dois tipos de isomeria, por sua vez, subdividem-se em isomerias mais específicas. Veja cada uma delas:
1. Isomeria plana ou constitucional: É aquela em que a diferença se encontra na estrutura plana dos compostos.
A isomeria plana é classificada em:
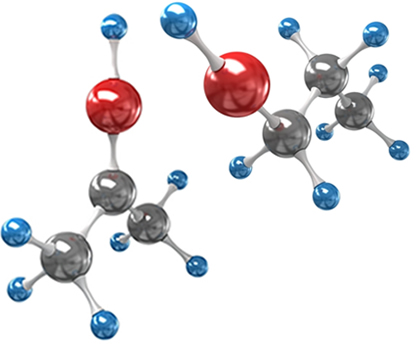
1.1. Isomeria de função: Os isômeros pertencem a funções diferentes;
Exemplo: Os dois compostos abaixo possuem a fórmula molecular C4H8O2, porém, um pertence ao grupo dos ácidos carboxílicos, enquanto o outro é um éster:
Ácido butanoico: Etanoato de etila:
O O
|| ||
H3C — CH2 — CH2 — C H3C —C
| |
OH O — CH2 — CH3
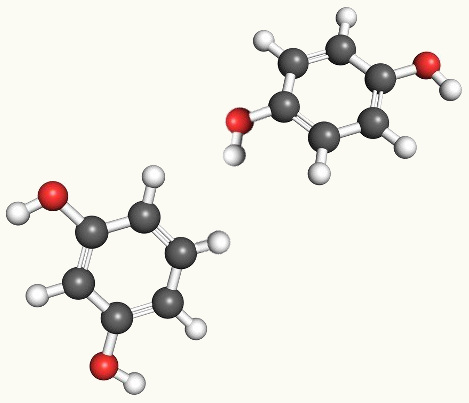
1.2. Isomeria de posição: Os isômeros pertencem à mesma função, mas o grupo funcional, uma ramificação ou uma insaturação, encontra-se em posições diferentes na cadeia;
Exemplo: Os compostos abaixo possuem a fórmula molecular igual a C3H8O e ambos são álcoois, mas a hidroxila está localizada em carbonos diferentes:
Propan-1-ol Propan-2-ol
OH OH
| |
H3C — CH2 — CH2 H3C —CH — CH3
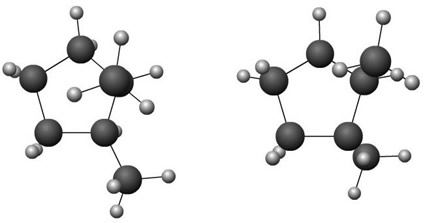
1.3. Isomeria de cadeia: Os isômeros pertencem à mesma função, porém apresentam cadeias diferentes (aberta ou fechada, normal ou ramificada, saturada ou insaturada);
Exemplo: A fórmula molecular dos compostos a seguir é C3H6, ambos são hidrocarbonetos, no entanto, o da esquerda possui cadeia fechada e saturada, enquanto o da direita possui cadeia aberta e insaturada:
Ciclo propano Propeno
CH2 H2C = CH — CH3
/ \
H2C — CH2
1.4. Isomeria de compensação ou metameria: Os heteroátomos (átomo diferente entre carbonos) se situam em posições diferentes;
Exemplo: A fórmula molecular de ambos os compostos abaixo é C3H6O2, sendo que a diferença é que no primeiro caso o oxigênio está entre os carbonos 1 e 2 e no segundo caso, ele está entre os carbonos 2 e 3:
Metanoato de etila Etanoato de metila
O O
|| ||
H— C H3C — C
| |
O — CH2 — CH3 O — CH2 — CH3
1.5. Isomeria dinâmica ou tautomeria: os isômeros coexistem em equilíbrio dinâmico e eles possuem funções diferentes.
Exemplo: Numa solução de aldeído acético (etanal), uma pequena parte se transforma em etenol – um enol, que, por sua vez, regenera-se novamente em aldeído. Assim, há um equilíbrio químico entre esses compostos que possuem a mesma fórmula molecular C2H4O.
Etanal Etenol
O OH
|| |
H3C — C — H ↔ H2C = C — H
aldeído enol
2. Isomeria espacial ou estereoisomeria: É aquela em que a diferença se encontra nas ligações entre os átomos que estão orientados de modo diferente no espaço.
Somente com a análise da estrutura espacial da molécula é que é possível determinar a isomeria, pois os estereoisômeros pertencem ao mesmo grupo funcional e à mesma cadeia, além das insaturações, ramificações, grupos funcionais, heteroátomos e substituintes estarem na mesma posição.
Existem dois tipos de isomerias espaciais:
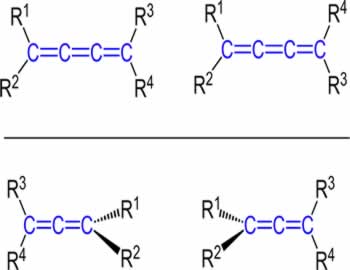
2.1. Isomeria geométrica ou cis-trans: Esse tipo de isomeria ocorre em compostos de cadeia aberta com pelo menos uma dupla ligação entre carbonos, que apresentam ligantes diferentes, ou em compostos cíclicos que devem apresentar ligantes diferentes em pelo menos dois carbonos.
Se os ligantes iguais (ou os ligantes com maiores números atômicos) dos carbonos da dupla estiverem do mesmo lado do plano, temos o isômero cis. Mas se eles estiverem em planos opostos, o isômero será trans.
Exemplo: Os dois compostos abaixo possuem a fórmula molecular C2H2Cl2. No primeiro caso, os ligantes iguais estão do mesmo lado (cis), já no segundo caso, eles estão em lados opostos (trans):
H3C CH3 H CH3
| | | |
C = C C = C
| | | |
H H H3C H
Cis-buteno Trans-buteno
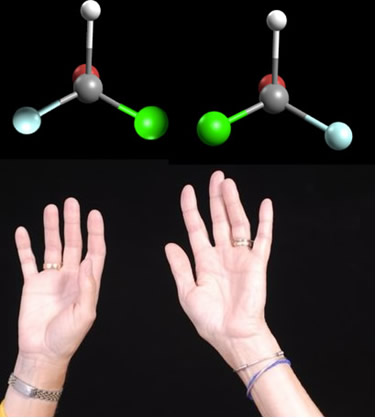
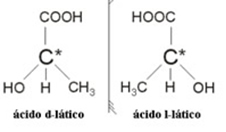
2.2. Isomeria óptica: Os isômeros ópticos se distinguem pela forma com que se comportam quando são submetidos a um feixe de luz polarizada.
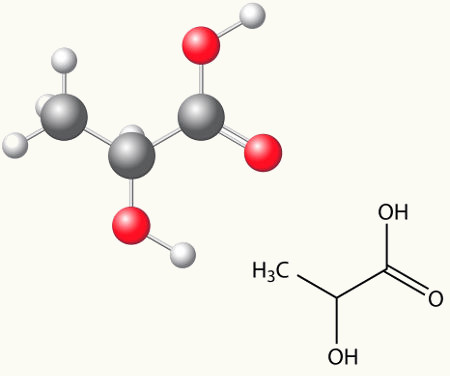
Exemplo: O ácido lático possui dois isômeros ópticos, isto é, que conseguem desviar o plano de luz polarizada. Um deles desvia o feixe de luz polarizada para a esquerda, sendo chamado de levogiro, e o outro desvia para a direita, sendo denominado dextrogiro.
Resumindo, os tipos de isomeria são:
.jpg)