Para calcular a velocidade com que ocorrem as reações, é possível tomar como base os reagentes que estão sendo consumidos ou os produtos que estão sendo formados, pelo tempo de cada processo. A escolha do processo de cálculo depende da reação que se está estudando.
Por exemplo, considere a reação genérica abaixo, em que dois reagentes diferentes se transformam em dois produtos diferentes:
A + B → C + D
Nesse caso, seriam quatro as possibilidades para se determinar a velocidade dessa reação. Confira abaixo:
1. Em relação aos reagentes:
1.1. Em relação ao reagente A:
V = ___quantidade consumida de reagente A___
Tempo gasto para o consumo desse reagente
1.2. Em relação ao reagente B:
V = ___quantidade consumida de reagente B__
Tempo gasto para o consumo desse reagente
2. Em relação aos produtos:
2.1. Em relação ao produto C:
V = ___quantidade formada de produto C___
Tempo gasto para a formação desse produto
2.2. Em relação ao produto D:
V = ___quantidade formada de produto D__
Tempo gasto para a formação desse produto
Visto que a velocidade da reação pode variar em cada instante e de uma substância para outra, normalmente se trabalha com a velocidade média da reação, que é dada pela relação entre a variação da concentração pelo intervalo de tempo (∆t):
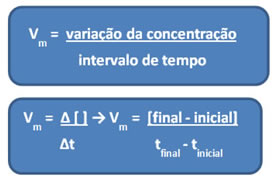
Conforme já foi dito, esse cálculo pode ser feito em relação aos reagentes ou aos produtos:
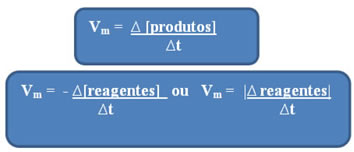
Observe que a fórmula da velocidade média em relação aos reagentes possui um sinal negativo. Isso ocorre porque, como os reagentes são consumidos, a sua variação daria negativa; assim, para acabar com esse problema, coloca-se o sinal negativo antes da fórmula ou considera-se o valor da sua variação em módulo: | |.
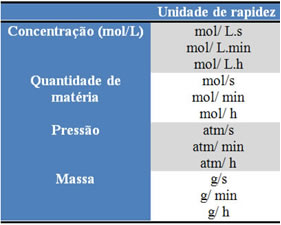
As unidades utilizadas dependem de como as quantidades dos reagentes ou produtos e o tempo estão sendo expressos. Por exemplo, se a concentração dos reagentes for dada em mol/L, ou seja, em concentração molar, e se o tempo estiver sendo contado em minutos, a velocidade média será dada em mol. L-1. min-1 ou mol/ L.min.
A quantidade de cada reagente ou produto pode ser expressa em massa, quantidade de matéria (mol), em volume, pressão, ou em qualquer outra grandeza conveniente. Já o tempo depende da rapidez com que a reação ocorre; se for rápida, normalmente se utiliza segundos ou microssegundos, se for moderada, ela é marcada em minutos e horas, porém, se for lenta, pode ser expressa em anos, séculos ou até milênios.
Algumas dessas unidades podem ser visualizadas abaixo:
Outra maneira de encontrar a velocidade média de uma reação é por meio dos coeficientes da reação de cada substância participante. Considere, por exemplo, a reação genérica abaixo, em que as letras minúsculas representam os coeficientes da reação; e as letras maiúsculas os reagentes e produtos:
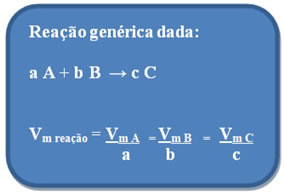
Essa definição foi convencionada pela União Internacional de Química Pura e Aplicada (IUPAC). Primeiro calcula-se a velocidade média de cada substância por meio das fórmulas anteriores mostradas e, posteriormente, divide-se o resultado pelo seu respectivo coeficiente estequiométrico.