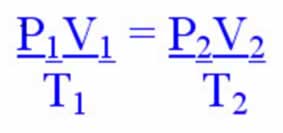O volume é uma grandeza que mede o espaço ocupado por um determinado corpo. Ela é uma das grandezas denominadas de variáveis de estado dos gases. As outras duas variáveis de estado dos gases são a pressão e a temperatura.
Todos os gases ideais possuem massa, porém, não possuem volume nem forma definida. Os gases são compostos de partículas minúsculas que se movimentam de modo bem veloz, livre e desordenado. Desse modo, as partículas que compõem os gases ocupam o volume total do recipiente mesmo em pequenas quantidades e por maior que seja o recipiente.
Portanto, o volume de um gás é igual ao volume do recipiente que o contém. Isso se aplica apenas para gases ideais, porque no caso dos gases reais, em condições de pressão muito alta e/ou temperatura muito baixa, o volume do gás diminui bastante, e as partículas ficam mais próximas, atraindo-se e afetando o movimento umas das outras. Assim, na realidade, o volume das partículas dos gases é muito pequeno, mas não é desprezível.
O movimento dessas partículas depende diretamente da temperatura, pois quanto maior ela for, maior será a agitação térmica ou o movimento das partículas. As partículas colidem umas com as outras de forma perfeitamente elástica, de modo que a energia mecânica total das duas partículas permanece a mesma, apesar de que elas podem perder energia uma para a outra.
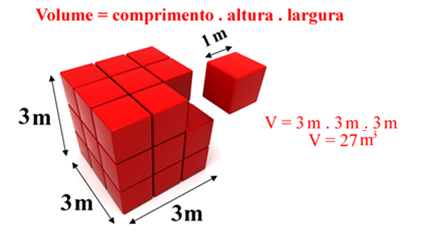
A IUPAC (União Internacional da Química Pura e Aplicada) adota a mesma unidade que o Sistema Internacional de Unidades (SI), que no caso do volume é o metro cúbico (m3), que é definido como o volume de um cubo cuja aresta tem 1 m de comprimento.
No entanto, trabalha-se também com outras unidades, como o litro e o mililitro. Os fatores de conversão são dados abaixo:

Quando ocorrem transformações gasosas envolvendo o volume (transformações que não são isovolumétricas), verifica-se que a massa de gás ocupa um volume inversamente proporcional à sua pressão (transformação isotérmica) e diretamente proporcional à temperatura termodinâmica (transformação isobárica).